Imena svih kemijskih elemenata periodnog sustava. Abecedni popis kemijskih elemenata
Ako vam je periodni sustav teško razumjeti, niste jedini! Iako može biti teško razumjeti njegova načela, učenje kako ga koristiti pomoći će vam pri proučavanju znanosti. Prvo proučite strukturu tablice i koje informacije iz nje možete saznati o svakom kemijskom elementu. Zatim možete početi proučavati svojstva svakog elementa. I konačno, pomoću periodnog sustava možete odrediti broj neutrona u atomu određenog kemijskog elementa.
Koraci
1. dio
Struktura tablice-
Kao što vidite, svaki sljedeći element sadrži jedan proton više od elementa koji mu prethodi. To je očito kada pogledate atomske brojeve. Atomski brojevi povećavaju se za jedan kako se pomičete slijeva nadesno. Budući da su elementi raspoređeni u skupine, neke ćelije tablice ostaju prazne.
- Na primjer, prvi redak tablice sadrži vodik, koji ima atomski broj 1, i helij, koji ima atomski broj 2. Međutim, oni se nalaze na suprotnim rubovima jer pripadaju različitim skupinama.
-
Naučite o skupinama koje sadrže elemente sličnih fizikalnih i kemijskih svojstava. Elementi svake skupine nalaze se u odgovarajućem okomitom stupcu. Obično se identificiraju istom bojom, što pomaže u prepoznavanju elemenata sa sličnim fizičkim i kemijskim svojstvima i predviđanju njihovog ponašanja. Svi elementi određene skupine imaju isti broj elektrona u svojoj vanjskoj ljusci.
- Vodik se može klasificirati i kao alkalijske metale i kao halogene. U nekim tablicama naznačeno je u obje skupine.
- U većini slučajeva grupe su označene brojevima od 1 do 18, a brojevi se nalaze na vrhu ili dnu tablice. Brojevi se mogu navesti rimskim (npr. IA) ili arapskim (npr. 1A ili 1) brojevima.
- Kada se krećete po stupcu od vrha prema dolje, kaže se da "pregledavate grupu".
-
Saznajte zašto su u tablici prazna polja. Elementi su poredani ne samo prema svom atomskom broju, već i prema skupini (elementi u istoj skupini imaju slična fizikalna i kemijska svojstva). Zahvaljujući tome, lakše je razumjeti kako se određeni element ponaša. Međutim, kako se atomski broj povećava, elementi koji spadaju u odgovarajuću skupinu nisu uvijek pronađeni, pa u tablici postoje prazna polja.
- Na primjer, prva 3 retka imaju prazne ćelije jer se prijelazni metali nalaze samo od atomskog broja 21.
- Elementi s atomskim brojevima od 57 do 102 klasificirani su kao elementi rijetkih zemalja i obično se nalaze u vlastitoj podskupini u donjem desnom kutu tablice.
-
Svaki redak tablice predstavlja točku. Svi elementi iste periode imaju isti broj atomskih orbitala u kojima se nalaze elektroni u atomima. Broj orbitala odgovara broju perioda. Tablica se sastoji od 7 redaka, odnosno 7 točaka.
- Na primjer, atomi elemenata prve periode imaju jednu orbitalu, a atomi elemenata sedme periode imaju 7 orbitala.
- Razdoblja su u pravilu označena brojevima od 1 do 7 na lijevoj strani tablice.
- Dok se krećete po liniji slijeva nadesno, kaže se da "skenirate razdoblje".
-
Naučiti razlikovati metale, metaloide i nemetale. Bolje ćete razumjeti svojstva elementa ako možete odrediti koji je tip. Radi praktičnosti, u većini tablica metali, metaloidi i nemetali označeni su različitim bojama. Metali su na lijevoj, a nemetali na desnoj strani stola. Između njih nalaze se metaloidi.
2. dio
Oznake elemenata-
Svaki element označen je jednim ili dva latinična slova. U pravilu je simbol elementa prikazan velikim slovima u sredini odgovarajuće ćelije. Simbol je skraćeni naziv za element koji je isti u većini jezika. Simboli elemenata obično se koriste pri izvođenju eksperimenata i radu s kemijskim jednadžbama, stoga ih je korisno zapamtiti.
- Tipično, simboli elemenata su kratice njihovog latinskog naziva, iako su za neke, posebno nedavno otkrivene elemente, izvedeni iz uobičajenog naziva. Na primjer, helij je predstavljen simbolom He, koji je blizak uobičajenom nazivu u većini jezika. Pritom se željezo označava kao Fe, što je skraćenica njegovog latinskog naziva.
-
Obratite pozornost na puni naziv elementa ako je naveden u tablici. Ovaj element "ime" koristi se u redovnim tekstovima. Na primjer, "helij" i "ugljik" su imena elemenata. Obično, iako ne uvijek, puni nazivi elemenata navedeni su ispod njihovog kemijskog simbola.
- Ponekad tablica ne označava nazive elemenata i daje samo njihove kemijske simbole.
-
Pronađite atomski broj. Obično se atomski broj elementa nalazi na vrhu odgovarajuće ćelije, u sredini ili u kutu. Također se može pojaviti ispod simbola ili naziva elementa. Elementi imaju atomske brojeve od 1 do 118.
- Atomski broj je uvijek cijeli broj.
-
Zapamtite da atomski broj odgovara broju protona u atomu. Svi atomi elementa sadrže isti broj protona. Za razliku od elektrona, broj protona u atomima elementa ostaje konstantan. Inače biste dobili drugačiji kemijski element!
- Atomski broj elementa također može odrediti broj elektrona i neutrona u atomu.
-
Obično je broj elektrona jednak broju protona. Iznimka je slučaj kada je atom ioniziran. Protoni imaju pozitivan, a elektroni negativan naboj. Budući da su atomi obično neutralni, sadrže isti broj elektrona i protona. Međutim, atom može dobiti ili izgubiti elektrone, u kojem slučaju postaje ioniziran.
- Ioni imaju električni naboj. Ako ion ima više protona, ima pozitivan naboj, u kojem slučaju se znak plus stavlja iza simbola elementa. Ako ion sadrži više elektrona, ima negativan naboj, označen znakom minus.
- Znakovi plus i minus ne koriste se ako atom nije ion.
-
Periodni sustav, odnosno periodni sustav kemijskih elemenata, počinje u gornjem lijevom kutu i završava na kraju zadnjeg retka tablice (donji desni kut). Elementi u tablici poredani su s lijeva na desno u rastućem redoslijedu prema njihovom atomskom broju. Atomski broj pokazuje koliko se protona nalazi u jednom atomu. Osim toga, s povećanjem atomskog broja, povećava se i atomska masa. Dakle, prema položaju elementa u periodnom sustavu elemenata, može se odrediti njegova atomska masa.
Vidi također: Popis kemijskih elemenata prema atomskom broju i Abecedni popis kemijskih elemenata Sadržaj 1 Simboli koji se trenutno koriste ... Wikipedia
Vidi također: Popis kemijskih elemenata prema simbolu i Abecedni popis kemijskih elemenata Ovo je popis kemijskih elemenata poredanih prema rastućem atomskom broju. Tablica prikazuje naziv elementa, simbol, grupu i točku u... ... Wikipediji
Glavni članak: Popisi kemijskih elemenata Sadržaj 1 Elektronička konfiguracija 2 Reference 2.1 NIST ... Wikipedia
Glavni članak: Popisi kemijskih elemenata Br. Simbol Naziv Mohsova tvrdoća Vickersova tvrdoća (GPa) Brinnellova tvrdoća (GPa) 3 Li Litij 0,6 4 Be Berilij 5,5 1,67 0,6 5 B Bor 9,5 49 6 C Ugljik 1,5 (grafit) 6...Wikipedia
Vidi također: Popis kemijskih elemenata po atomskom broju i Popis kemijskih elemenata po simbolu Abecedni popis kemijskih elemenata. Dušik N Aktinij Ac Aluminij Al Americij Am Argon Ar Astatin At ... Wikipedia
Glavni članak: Popisi kemijskih elemenata Br. Simbol Rusko ime Latinsko ime Etimologija naziva 1 H Vodik Hidrogenij Od dr. grč. ὕδωρ “voda” i γεννάω “rađam”. 2 ... Wikipedija
Popis simbola kemijskih elemenata su simboli (znakovi), šifre ili kratice koje služe za kratak ili vizualni prikaz naziva istoimenih kemijskih elemenata i jednostavnih tvari. Prije svega, to su simboli kemijskih elemenata ... Wikipedia
Ispod su nazivi pogrešno otkrivenih kemijskih elemenata (s naznakom autora i datuma otkrića). Svi dolje navedeni elementi otkriveni su kao rezultat eksperimenata provedenih više ili manje objektivno, ali obično netočno... ... Wikipedia
Preporučene vrijednosti za mnoga svojstva elemenata, zajedno s raznim referencama, prikupljene su na ovim stranicama. Sve promjene u vrijednostima u infoboxu moraju se usporediti s danim vrijednostima i/ili dati u skladu s tim ... ... Wikipedia
Kemijski simbol dvoatomne molekule klora 35 Simboli kemijskih elemenata (kemijski simboli) simbol kemijskih elemenata. Zajedno s kemijskim formulama, dijagramima i jednadžbama kemijskih reakcija čine formalni jezik... ... Wikipedia
knjige
- Japansko-englesko-ruski rječnik za instalaciju industrijske opreme. Oko 8000 pojmova, Popova I.S.. Rječnik je namijenjen širokom krugu korisnika, a prvenstveno prevoditeljima i tehničkim stručnjacima uključenim u nabavu i implementaciju industrijske opreme iz Japana ili...
- Engleski za doktore. 8. izd. , Muraveyskaya Marianna Stepanovna, Orlova Larisa Konstantinovna. 384 str. Namjena udžbenika je podučavanje čitanja i prevođenja engleskih medicinskih tekstova, vođenje razgovora iz različitih područja medicine. Sastoji se od kratkog uvodnog fonetskog i...
Silicij(lat. Silicium), Si, kemijski element IV skupine periodnog sustava Mendeljejeva; atomski broj 14, atomska masa 28.086. U prirodi je element predstavljen s tri stabilna izotopa: 28 Si (92,27%), 29 Si (4,68%) i 30 Si (3,05%).
Povijesna referenca. K spojevi, rasprostranjeni na zemlji, poznati su čovjeku još od kamenog doba. Korištenje kamenog oruđa za rad i lov nastavilo se nekoliko tisućljeća. Upotreba spojeva K povezana s njihovom preradom - proizvodnjom stakla- započela je oko 3000. pr. e. (u starom Egiptu). Najraniji poznati spoj K. je SiO 2 dioksid (silicijev dioksid). U 18. stoljeću silicij se smatrao jednostavnim tijelom i nazivalo se "zemljama" (što se odražava u njegovom nazivu). Složenost sastava silicija utvrdio je I. Ya. Berzelius. Po prvi put, 1825. godine, dobio je elementarni silicij iz silicijevog fluorida SiF 4, reducirajući ga metalnim kalijem. Novi element je dobio ime "silicij" (od latinskog silex - kremen). Ruski naziv uveo je G.I. Hess godine 1834.
Rasprostranjenost u prirodi. U pogledu rasprostranjenosti u zemljinoj kori, kisik je drugi element (nakon kisika), njegov prosječni sadržaj u litosferi je 29,5% (po masi). Ugljik u zemljinoj kori ima istu primarnu ulogu kao ugljik u životinjskom i biljnom svijetu. Za geokemiju kisika važna je njegova izuzetno jaka povezanost s kisikom. Oko 12% litosfere čini silicijev dioksid SiO 2 u obliku minerala kvarcni i njegove sorte. 75% litosfere sastoji se od raznih silikati I alumosilikati(feldspati, tinjci, amfiboli itd.). Ukupan broj minerala koji sadrže silicij premašuje 400 (vidi sl. Minerali silicija).
Tijekom magmatskih procesa dolazi do slabe diferencijacije kalcija: nakuplja se iu granitoidima (32,3%) iu ultrabazičnim stijenama (19%). Pri visokim temperaturama i visokom tlaku, topljivost SiO 2 se povećava. Moguća je i njegova migracija s vodenom parom, stoga pegmatite hidrotermalnih žila karakteriziraju značajne koncentracije kvarca, koji je često povezan s rudnim elementima (zlato-kvarcne, kvarc-kasiteritne i dr. žile).
Fizička i kemijska svojstva. C. tvori tamnosive kristale s metalnim sjajem, koji imaju kubičnu dijamantnu rešetku s točkom A= 5,431Å, gustoća 2,33 g/cm3. Pri vrlo visokim tlakovima dobivena je nova (naizgled heksagonalna) modifikacija gustoće 2,55 g/cm3. K. se tali na 1417°C, vrije na 2600°C. Specifični toplinski kapacitet (pri 20-100°C) 800 j/(kg× DO), odnosno 0,191 kal/(G× tuča); toplinska vodljivost čak i za najčišće uzorke nije konstantna i kreće se u rasponu (25°C) 84-126 uto/(m× DO), odnosno 0,20-0,30 kal/(cm× sek× tuča). Temperaturni koeficijent linearnog širenja 2,33×10 -6 K -1 ; ispod 120K postaje negativan. K. je proziran za dugovalne infracrvene zrake; indeks loma (za l =6 µm) 3,42; dielektrična konstanta 11.7. K. je dijamagnetičan, atomska magnetska susceptibilnost je -0,13×10 -6. Tvrdoća K po Mohsu 7.0, po Brinellu 2.4 Gn/m 2 (240 kgf/mm 2), modul elastičnosti 109 Gn/m 2 (10890 kgf/mm 2), koeficijent stišljivosti 0,325×10 -6 cm 2 /kg. K. krti materijal; primjetna plastična deformacija počinje na temperaturama iznad 800°C.
K. je poluvodič koji nalazi sve veću primjenu. Električna svojstva bakra jako ovise o nečistoćama. Unutarnji specifični volumetrijski električni otpor ćelije na sobnoj temperaturi je 2,3 × 10 3 ohm× m(2,3×10 5 ohm× cm).
Poluvodički krug s vodljivošću R-tip (aditivi B, Al, In ili Ga) i n-tip (aditivi P, Bi, As ili Sb) ima znatno manju otpornost. Zazor pojasa prema električnim mjerenjima je 1,21 ev na 0 DO i smanjuje se na 1,119 ev na 300 DO.
U skladu s položajem prstena u Mendeljejevljevom periodnom sustavu, 14 elektrona atoma prstena raspoređeno je u tri ljuske: u prvoj (od jezgre) 2 elektrona, u drugoj 8, u trećoj (valencija) 4; konfiguracija elektronske ljuske 1s 2 2s 2 2p 6 3s 2 3p 2(cm. Atom). Potencijali sukcesivne ionizacije ( ev): 8,149; 16.34; 33.46 i 45.13. Atomski radijus 1,33Å, kovalentni radijus 1,17Å, ionski radijus Si 4+ 0,39Å, Si 4- 1,98Å.
U spojevima ugljika (slično ugljiku) 4-valenten. No, za razliku od ugljika, silicij, uz koordinacijski broj 4, ima i koordinacijski broj 6, što se objašnjava velikim volumenom njegovog atoma (primjer takvih spojeva su silikofluoridi koji sadrže 2- skupinu).
Kemijska veza atoma ugljika s drugim atomima obično se odvija zahvaljujući hibridnim sp 3 orbitalama, ali također je moguće uključiti dvije od njegovih pet (upražnjenih) 3 d- orbitale, osobito kad je K. šesterokoordinatna. Imajući nisku vrijednost elektronegativnosti od 1,8 (nasuprot 2,5 za ugljik; 3,0 za dušik, itd.), ugljik je elektropozitivan u spojevima s nemetalima, a ti su spojevi polarne prirode. Visoka energija vezanja s kisikom Si-O, jednaka 464 kJ/mol(111 kcal/mol), određuje stabilnost njegovih kisikovih spojeva (SiO 2 i silikata). Si-Si energija veze je niska, 176 kJ/mol (42 kcal/mol); Za razliku od ugljika, silicij nije karakteriziran stvaranjem dugih lanaca i dvostrukih veza između Si atoma. Na zraku, zbog stvaranja zaštitnog oksidnog filma, ugljik je stabilan čak i pri povišenim temperaturama. U kisiku oksidira počevši od 400°C, stvarajući silicij dioksid SiO2. Poznat je i monoksid SiO, stabilan na visokim temperaturama u obliku plina; kao rezultat naglog hlađenja može se dobiti čvrsti produkt koji se lako raspada u rijetku smjesu Si i SiO 2. K. je otporan na kiseline i otapa se samo u smjesi dušične i fluorovodične kiseline; lako se otapa u vrućim otopinama lužina uz oslobađanje vodika. K. reagira s fluorom na sobnoj temperaturi, s drugim halogenima kada se zagrijava da bi se formirali spojevi opće formule SiX 4 (vidi. Silicijevi halogenidi). Vodik ne reagira izravno s ugljikom, i silicijeve kiseline(silani) dobivaju se razgradnjom silicida (vidi dolje). Vodikovi silikoni poznati su od SiH 4 do Si 8 H 18 (sastav je sličan zasićenim ugljikovodicima). K. tvori 2 skupine silana koji sadrže kisik - siloksani i silokseni. K reagira s dušikom na temperaturama iznad 1000°C. Od velike praktične važnosti je Si 3 N 4 nitrid, koji ne oksidira na zraku čak ni na 1200°C, otporan je na kiseline (osim dušične) i lužine, kao i rastaljene metale i trosku, što ga čini dragocjenim materijalom za kemijskoj industriji, za proizvodnju vatrostalnih materijala itd. Spojevi ugljika s ugljikom odlikuju se visokom tvrdoćom, kao i toplinskom i kemijskom otpornošću ( silicijev karbid SiC) i s borom (SiB 3, SiB 6, SiB 12). Kada se zagrijava, klor reagira (u prisutnosti metalnih katalizatora, kao što je bakar) s organoklornim spojevima (na primjer, CH 3 Cl) kako bi se formirali organohalosilani [na primjer, Si (CH 3) 3 CI], koji se koriste za sintezu od brojnih organosilikonski spojevi.
K. tvori spojeve s gotovo svim metalima - silicidi(samo spojevi s Bi, Tl, Pb, Hg nisu otkriveni). Dobiveno je više od 250 silicida čiji sastav (MeSi, MeSi 2, Me 5 Si 3, Me 3 Si, Me 2 Si itd.) obično ne odgovara klasičnim valencijama. Silicidi su vatrostalni i tvrdi; Ferosilicij je od najvećeg praktičnog značaja (redukcijsko sredstvo pri taljenju specijalnih legura, vidi Ferolegura) i molibden silicid MoSi 2 (grijači električnih peći, lopatice plinskih turbina, itd.).
Prijem i prijava. K. tehničke čistoće (95-98%) dobiva se u električnom luku redukcijom silicija SiO 2 između grafitnih elektroda. U vezi s razvojem tehnologije poluvodiča razvijene su metode za dobivanje čistog i posebno čistog bakra, što zahtijeva prethodnu sintezu najčišćih polaznih spojeva bakra, iz kojih se bakar ekstrahira redukcijom ili toplinskom razgradnjom.
Čisti poluvodički bakar dobiva se u dva oblika: polikristalnom (redukcijom SiCI 4 ili SiHCl 3 cinkom ili vodikom, toplinskom razgradnjom Sil 4 i SiH 4) i monokristalnom (taljenjem zone bez lončića i "izvlačenjem" monokristala iz rastaljenog bakra – metoda Czochralskog).
Posebno dopirani bakar naširoko se koristi kao materijal za izradu poluvodičkih uređaja (tranzistori, termistori, ispravljači snage, kontrolirane diode - tiristori; solarne fotoćelije koje se koriste u svemirskim letjelicama itd.). Budući da je K. proziran za zrake valnih duljina od 1 do 9 µm, koristi se u infracrvenoj optici (vidi također Kvarcni).
K. ima raznolika i sve veća područja primjene. U metalurgiji se kisik koristi za uklanjanje kisika otopljenog u rastaljenim metalima (deoksidacija). K. je sastavni dio velikog broja legura željeza i obojenih metala. Obično ugljik daje legurama povećanu otpornost na koroziju, poboljšava njihova svojstva lijevanja i povećava mehaničku čvrstoću; no s većim sadržajem K. može uzrokovati krhkost. Najvažnije su legure željeza, bakra i aluminija koje sadrže kalcij.Sve se više ugljika koristi za sintezu organosilicijevih spojeva i silicida. Silicij i mnogi silikati (gline, feldspati, tinjac, talk, itd.) prerađuju se u industriji stakla, cementa, keramike, elektrotehnici i drugim industrijama.
V. P. Barzakovsky.
Silicij se u tijelu nalazi u obliku raznih spojeva, uglavnom uključenih u stvaranje tvrdih dijelova kostura i tkiva. Neke morske biljke (na primjer dijatomeje) i životinje (na primjer silikatne spužve, radiolarije) mogu akumulirati posebno velike količine silicija, stvarajući debele naslage silicijevog dioksida na dnu oceana kada umru. U hladnim morima i jezerima prevladavaju biogeni muljevi obogaćeni kalijem, u tropskim morima prevladavaju vapnenasti muljevi s niskim udjelom kalija, a među kopnenim biljkama mnogo kalija nakupljaju žitarice, šaš, palme i preslice. Kod kralješnjaka sadržaj silicijeva dioksida u pepelnim tvarima iznosi 0,1-0,5%. U najvećim količinama K. se nalazi u gustom vezivnom tkivu, bubrezima i gušterači. Dnevna ljudska prehrana sadrži do 1 G K. Kada je u zraku visok sadržaj prašine silicijevog dioksida, on ulazi u ljudska pluća i uzrokuje bolest - silikoza.
V. V. Kovalskog.
Lit.: Berezhnoy A.S., Silicij i njegovi binarni sustavi. K., 1958.; Krasyuk B. A., Gribov A. I., Poluvodiči - germanij i silicij, M., 1961.; Renyan V.R., Tehnologija poluvodičkog silicija, trans. s engleskog, M., 1969.; Sally I.V., Falkevich E.S., Proizvodnja poluvodičkog silicija, M., 1970.; Silicij i germanij. sub. čl., ur. E. S. Falkevich, D. I. Levinzon, V. 1-2, M., 1969-70; Gladyshevsky E.I., Kristalna kemija silicida i germanida, M., 1971; Wolf N. F., Podaci o silicijskom poluvodiču, Oxf. - N.Y., 1965.
Vidi također: Popis kemijskih elemenata prema atomskom broju i Abecedni popis kemijskih elemenata Sadržaj 1 Simboli koji se trenutno koriste ... Wikipedia
Vidi također: Popis kemijskih elemenata prema simbolu i Abecedni popis kemijskih elemenata Ovo je popis kemijskih elemenata poredanih prema rastućem atomskom broju. Tablica prikazuje naziv elementa, simbol, grupu i točku u... ... Wikipediji
- (ISO 4217) Kodovi za predstavljanje valuta i fondova (engleski) Codes pour la représentation des monnaies et types de fonds (francuski) ... Wikipedia
Najjednostavniji oblik materije koji se može identificirati kemijskim metodama. To su komponente jednostavnih i složenih tvari, koje predstavljaju skup atoma s istim nuklearnim nabojem. Naboj jezgre atoma određen je brojem protona u... Collierova enciklopedija
Sadržaj 1 Paleolitik 2 10. tisućljeće pr. e. 3 9. tisućljeće pr uh... Wikipedia
Sadržaj 1 Paleolitik 2 10. tisućljeće pr. e. 3 9. tisućljeće pr uh... Wikipedia
Ovaj pojam ima i druga značenja, pogledajte ruski (značenja). Rusi... Wikipedia
Terminologija 1: : dw Broj dana u tjednu. “1” odgovara ponedjeljku. Definicije pojma iz različitih dokumenata: dw DUT Razlika između moskovskog i UTC vremena, izražena kao cijeli broj sati Definicije pojma od ... ... Rječnik-priručnik pojmova normativne i tehničke dokumentacije
Kako koristiti periodni sustav elemenata? Za neupućenu osobu, čitanje periodnog sustava isto je što i za gnoma koji gleda drevne rune vilenjaka. A periodni sustav može vam puno reći o svijetu.
Osim što će dobro poslužiti na ispitu, jednostavno je nezamjenjiv u rješavanju ogromnog broja kemijskih i fizikalnih problema. Ali kako to čitati? Srećom, danas svatko može naučiti ovu umjetnost. U ovom članku ćemo vam reći kako razumjeti periodni sustav.
Periodni sustav kemijskih elemenata (Mendeljejevljeva tablica) je klasifikacija kemijskih elemenata koja utvrđuje ovisnost različitih svojstava elemenata o naboju atomske jezgre.
Povijest nastanka Stola
Dmitrij Ivanovič Mendeljejev nije bio običan kemičar, ako netko tako misli. Bio je kemičar, fizičar, geolog, metrolog, ekolog, ekonomist, naftni radnik, aeronaut, instrumentar i učitelj. Tijekom svog života, znanstvenik je uspio provesti mnogo temeljnih istraživanja u različitim područjima znanja. Na primjer, uvriježeno je mišljenje da je Mendeljejev izračunao idealnu jačinu votke - 40 stupnjeva.
Ne znamo kako je Mendeljejev mislio o votki, ali pouzdano znamo da njegova disertacija na temu "Rasprava o spoju alkohola s vodom" nije imala nikakve veze s votkom i razmatrala je koncentracije alkohola od 70 stupnjeva. Uz sve zasluge znanstvenika, otkriće periodičnog zakona kemijskih elemenata - jednog od temeljnih zakona prirode, donijelo mu je najširu slavu.

Postoji legenda prema kojoj je jedan znanstvenik sanjao periodni sustav, nakon čega je samo trebao doraditi ideju koja se pojavila. Ali, kad bi sve bilo tako jednostavno.. Ova verzija stvaranja periodnog sustava, očito, nije ništa više od legende. Na pitanje kako je stol otvoren, sam Dmitrij Ivanovič je odgovorio: " Razmišljao sam o tome možda dvadeset godina, ali vi mislite: sjedio sam tamo i odjednom... gotovo je.”
Sredinom devetnaestog stoljeća nekoliko je znanstvenika paralelno pokušavalo složiti poznate kemijske elemente (bila su poznata 63 elementa). Na primjer, 1862. Alexandre Emile Chancourtois postavio je elemente duž spirale i primijetio cikličko ponavljanje kemijskih svojstava.
Kemičar i glazbenik John Alexander Newlands predložio je svoju verziju periodnog sustava 1866. godine. Zanimljiva je činjenica da je znanstvenik pokušao otkriti neku vrstu mistične glazbene harmonije u rasporedu elemenata. Između ostalih pokušaja, tu je i Mendeljejevljev pokušaj, koji je okrunjen uspjehom.

Godine 1869. objavljen je prvi tablični dijagram, a 1. ožujka 1869. smatra se danom otvaranja periodičnog zakona. Bit Mendelejevljeva otkrića bila je u tome da se svojstva elemenata s povećanjem atomske mase ne mijenjaju monotono, već periodički.
Prva verzija tablice sadržavala je samo 63 elementa, ali Mendeljejev je donio niz vrlo nekonvencionalnih odluka. Dakle, pogodio je ostaviti prostor u tablici za još neotkrivene elemente, a također je promijenio atomske mase nekih elemenata. Temeljna ispravnost zakona koji je izveo Mendeljejev potvrđena je vrlo brzo, nakon otkrića galija, skandijuma i germanija, čije je postojanje znanstvenik predvidio.
Suvremeni pogled na periodni sustav
Ispod je sama tablica

Danas se umjesto atomske težine (atomske mase) za poredak elemenata koristi pojam atomskog broja (broj protona u jezgri). Tablica sadrži 120 elemenata, koji su poredani s lijeva na desno prema rastućem atomskom broju (broju protona)
Stupci tablice predstavljaju takozvane grupe, a reci predstavljaju razdoblja. Tablica ima 18 grupa i 8 perioda.
- Metalna svojstva elemenata opadaju kada se pomiču periodom slijeva nadesno, a povećavaju u suprotnom smjeru.
- Veličine atoma smanjuju se pri pomicanju slijeva nadesno duž perioda.
- Kako se krećete odozgo prema dolje kroz grupu, svojstva redukcijskih metala se povećavaju.
- Oksidirajuća i nemetalna svojstva povećavaju se kako se krećete duž perioda slijeva nadesno.
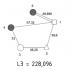
Što saznajemo o elementu iz tablice? Na primjer, uzmimo treći element u tablici - litij, i razmotrimo ga detaljno.

Prije svega, vidimo sam simbol elementa i njegovo ime ispod njega. U gornjem lijevom kutu nalazi se atomski broj elementa, kojim je redom element poredan u tablici. Atomski broj, kao što je već spomenuto, jednak je broju protona u jezgri. Broj pozitivnih protona obično je jednak broju negativnih elektrona u atomu (osim u izotopima).
Atomska masa navedena je pod atomskim brojem (u ovoj verziji tablice). Zaokružimo li atomsku masu na najbliži cijeli broj, dobit ćemo ono što se naziva maseni broj. Razlika između masenog broja i atomskog broja daje broj neutrona u jezgri. Tako je broj neutrona u jezgri helija dva, a u litiju četiri.
Završio je naš tečaj Periodical Table for Dummies. Zaključno, pozivamo vas da pogledate tematski video i nadamo se da vam je postalo jasnije pitanje kako koristiti periodni sustav Mendelejeva. Podsjećamo vas da je uvijek učinkovitije proučavati novi predmet ne sami, već uz pomoć iskusnog mentora. Zato nikako ne zaboravite na studentski servis koji će s Vama rado podijeliti svoje znanje i iskustvo.