Nombres de todos los elementos químicos de la tabla periódica. Lista alfabética de elementos químicos.
Si le resulta difícil entender la tabla periódica, ¡no está solo! Aunque puede resultar difícil comprender sus principios, aprender a utilizarlo te ayudará a la hora de estudiar ciencias. Primero, estudia la estructura de la tabla y qué información puedes aprender de ella sobre cada elemento químico. Entonces podrás comenzar a estudiar las propiedades de cada elemento. Y finalmente, utilizando la tabla periódica, puede determinar la cantidad de neutrones en un átomo de un elemento químico en particular.
Pasos
Parte 1
Estructura de la mesa-
Como puede ver, cada elemento posterior contiene un protón más que el elemento que lo precede. Esto es obvio cuando nos fijamos en los números atómicos. Los números atómicos aumentan en uno a medida que se mueve de izquierda a derecha. Debido a que los elementos están organizados en grupos, algunas celdas de la tabla quedan vacías.
- Por ejemplo, la primera fila de la tabla contiene hidrógeno, que tiene número atómico 1, y helio, que tiene número atómico 2. Sin embargo, están ubicados en bordes opuestos porque pertenecen a grupos diferentes.
-
Aprenda sobre grupos que contienen elementos con propiedades físicas y químicas similares. Los elementos de cada grupo se ubican en la columna vertical correspondiente. Por lo general, se identifican por el mismo color, lo que ayuda a identificar elementos con propiedades físicas y químicas similares y a predecir su comportamiento. Todos los elementos de un grupo particular tienen la misma cantidad de electrones en su capa exterior.
- El hidrógeno se puede clasificar tanto en metales alcalinos como en halógenos. En algunas tablas se indica en ambos grupos.
- En la mayoría de los casos, los grupos están numerados del 1 al 18 y los números se colocan en la parte superior o inferior de la tabla. Los números se pueden especificar en números romanos (por ejemplo, IA) o arábigos (por ejemplo, 1A o 1).
- Cuando se mueve a lo largo de una columna de arriba a abajo, se dice que está "explorando un grupo".
-
Descubra por qué hay celdas vacías en la tabla. Los elementos están ordenados no sólo según su número atómico, sino también por grupo (los elementos de un mismo grupo tienen propiedades físicas y químicas similares). Gracias a esto, es más fácil entender cómo se comporta un elemento en particular. Sin embargo, a medida que aumenta el número atómico, no siempre se encuentran elementos que caen en el grupo correspondiente, por lo que hay celdas vacías en la tabla.
- Por ejemplo, las primeras 3 filas tienen celdas vacías porque los metales de transición solo se encuentran a partir del número atómico 21.
- Los elementos con números atómicos del 57 al 102 se clasifican como elementos de tierras raras y normalmente se colocan en su propio subgrupo en la esquina inferior derecha de la tabla.
-
Cada fila de la tabla representa un período. Todos los elementos del mismo período tienen el mismo número de orbitales atómicos en los que se encuentran los electrones de los átomos. El número de orbitales corresponde al número del período. La tabla contiene 7 filas, es decir, 7 períodos.
- Por ejemplo, los átomos de los elementos del primer período tienen un orbital y los átomos de los elementos del séptimo período tienen 7 orbitales.
- Como regla general, los períodos se designan con números del 1 al 7 a la izquierda de la tabla.
- A medida que avanza a lo largo de una línea de izquierda a derecha, se dice que está "escudriñando el período".
-
Aprenda a distinguir entre metales, metaloides y no metales. Comprenderá mejor las propiedades de un elemento si puede determinar de qué tipo es. Por conveniencia, en la mayoría de las tablas los metales, metaloides y no metales se designan con diferentes colores. Los metales están en el lado izquierdo de la tabla y los no metales en el lado derecho. Entre ellos se encuentran metaloides.
Parte 2
Designaciones de elementos-
Cada elemento está designado por una o dos letras latinas. Como regla general, el símbolo del elemento se muestra en letras grandes en el centro de la celda correspondiente. Un símbolo es un nombre abreviado para un elemento que es igual en la mayoría de los idiomas. Los símbolos de los elementos se usan comúnmente al realizar experimentos y trabajar con ecuaciones químicas, por lo que es útil recordarlos.
- Normalmente, los símbolos de los elementos son abreviaturas de su nombre latino, aunque para algunos, especialmente los elementos descubiertos recientemente, se derivan del nombre común. Por ejemplo, el helio está representado por el símbolo He, que se acerca al nombre común en la mayoría de los idiomas. Al mismo tiempo, el hierro se denomina Fe, que es una abreviatura de su nombre en latín.
-
Preste atención al nombre completo del elemento si aparece en la tabla. Este elemento "nombre" se utiliza en textos normales. Por ejemplo, "helio" y "carbono" son nombres de elementos. Generalmente, aunque no siempre, los nombres completos de los elementos aparecen debajo de su símbolo químico.
- A veces la tabla no indica los nombres de los elementos y sólo da sus símbolos químicos.
-
Encuentra el número atómico. Normalmente, el número atómico de un elemento se encuentra en la parte superior de la celda correspondiente, en el medio o en la esquina. También puede aparecer debajo del símbolo o nombre del elemento. Los elementos tienen números atómicos del 1 al 118.
- El número atómico es siempre un número entero.
-
Recuerda que el número atómico corresponde al número de protones en un átomo. Todos los átomos de un elemento contienen el mismo número de protones. A diferencia de los electrones, el número de protones en los átomos de un elemento permanece constante. De lo contrario, ¡obtendrías un elemento químico diferente!
- El número atómico de un elemento también puede determinar el número de electrones y neutrones en un átomo.
-
Generalmente el número de electrones es igual al número de protones. La excepción es el caso cuando el átomo está ionizado. Los protones tienen carga positiva y los electrones tienen carga negativa. Como los átomos suelen ser neutros, contienen la misma cantidad de electrones y protones. Sin embargo, un átomo puede ganar o perder electrones, en cuyo caso se ioniza.
- Los iones tienen carga eléctrica. Si un ion tiene más protones, tiene carga positiva, en cuyo caso se coloca un signo más después del símbolo del elemento. Si un ion contiene más electrones, tiene carga negativa, indicada por un signo menos.
- Los signos más y menos no se utilizan si el átomo no es un ion.
-
La tabla periódica, o tabla periódica de elementos químicos, comienza en la esquina superior izquierda y termina al final de la última fila de la tabla (esquina inferior derecha). Los elementos de la tabla están ordenados de izquierda a derecha en orden creciente de su número atómico. El número atómico muestra cuántos protones contiene un átomo. Además, a medida que aumenta el número atómico, también aumenta la masa atómica. Así, por la ubicación de un elemento en la tabla periódica, se puede determinar su masa atómica.
Ver también: Lista de elementos químicos por número atómico y Lista alfabética de elementos químicos Contenido 1 Símbolos utilizados actualmente ... Wikipedia
Ver también: Lista de elementos químicos por símbolo y Lista alfabética de elementos químicos Esta es una lista de elementos químicos ordenados en orden creciente de número atómico. La tabla muestra el nombre del elemento, símbolo, grupo y período en... ... Wikipedia
Artículo principal: Listas de elementos químicos Contenidos 1 Configuración electrónica 2 Referencias 2.1 NIST... Wikipedia
Artículo principal: Listas de elementos químicos No. Símbolo Nombre Dureza Mohs Dureza Vickers (GPa) Dureza Brinnell (GPa) 3 Li Litio 0,6 4 Be Berilio 5,5 1,67 0,6 5 B Boro 9,5 49 6 C Carbono 1,5 (grafito) 6...Wikipedia
Ver también: Lista de elementos químicos por número atómico y Lista de elementos químicos por símbolo Lista alfabética de elementos químicos. Nitrógeno N Actinio Ac Aluminio Al Americio Am Argón Ar Astato En ... Wikipedia
Artículo principal: Listas de elementos químicos No. Símbolo Nombre ruso Nombre latino Etimología del nombre 1 H Hidrógeno Hidrogenio De otro griego. ὕδωρ “agua” y γεννάω “yo doy a luz”. 2 ...Wikipedia
Lista de símbolos de elementos químicos son símbolos (signos), códigos o abreviaturas que se utilizan para una representación breve o visual de los nombres de elementos químicos y sustancias simples del mismo nombre. En primer lugar, estos son símbolos de elementos químicos ... Wikipedia
A continuación se muestran los nombres de los elementos químicos descubiertos por error (indicando los autores y las fechas de descubrimiento). Todos los elementos mencionados a continuación fueron descubiertos como resultado de experimentos realizados de manera más o menos objetiva, pero generalmente incorrecta... ... Wikipedia
En estas páginas se recopilan los valores recomendados para muchas propiedades de elementos, junto con varias referencias. Cualquier cambio en los valores en el cuadro de información debe compararse con los valores dados y / o darse en consecuencia ... ... Wikipedia
Símbolo químico de una molécula de cloro diatómico 35 Símbolos de elementos químicos (símbolos químicos) símbolo de elementos químicos. Junto con fórmulas químicas, diagramas y ecuaciones de reacciones químicas, forman un lenguaje formal... ... Wikipedia
Libros
- Diccionario japonés-inglés-ruso para instalación de equipos industriales. Alrededor de 8.000 términos, Popova I.S.. El diccionario está destinado a una amplia gama de usuarios y principalmente a traductores y especialistas técnicos involucrados en el suministro y la implementación de equipos industriales de Japón o...
- Inglés para médicos. 8ª ed. , Muraveyskaya Marianna Stepanovna, Orlova Larisa Konstantinovna. 384 págs. El objetivo del libro de texto es enseñar a leer y traducir textos médicos en inglés, realizando conversaciones en diversas áreas de la medicina. Consta de una breve introducción a la fonética y...
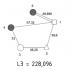
Silicio(lat. Silicio), Si, elemento químico del grupo IV del sistema periódico de Mendeleev; número atómico 14, masa atómica 28.086. En la naturaleza, el elemento está representado por tres isótopos estables: 28 Si (92,27%), 29 Si (4,68%) y 30 Si (3,05%).
Referencia histórica. Los compuestos K, muy extendidos en la Tierra, son conocidos por el hombre desde la Edad de Piedra. El uso de herramientas de piedra para el trabajo y la caza continuó durante varios milenios. El uso de compuestos K asociados con su procesamiento - producción. vaso- comenzó alrededor del 3000 a.C. mi. (en el Antiguo Egipto). El primer compuesto conocido de K. es el dióxido de SiO 2 (sílice). En el siglo 18 La sílice se consideraba un cuerpo simple y se la denominaba “tierras” (lo que se refleja en su nombre). La complejidad de la composición del sílice fue establecida por I. Ya. berzelius. Por primera vez, en 1825, obtuvo silicio elemental a partir de fluoruro de silicio SiF 4, reduciendo este último con potasio metálico. El nuevo elemento recibió el nombre de "silicio" (del latín silex - pedernal). El nombre ruso fue introducido por G.I. Hesse en 1834.
Prevalencia en la naturaleza. En términos de prevalencia en la corteza terrestre, el oxígeno es el segundo elemento (después del oxígeno), su contenido promedio en la litosfera es del 29,5% (en masa). En la corteza terrestre, el carbono desempeña el mismo papel principal que el carbono en el mundo animal y vegetal. Para la geoquímica del oxígeno es importante su conexión extremadamente fuerte con el oxígeno. Alrededor del 12% de la litosfera es sílice SiO 2 en forma del mineral cuarzo y sus variedades. El 75% de la litosfera se compone de varios silicatos Y aluminosilicatos(feldespatos, micas, anfíboles, etc.). El número total de minerales que contienen sílice supera los 400 (ver Fig. Minerales de sílice).
Durante los procesos magmáticos se produce una débil diferenciación del calcio: se acumula tanto en granitoides (32,3%) como en rocas ultrabásicas (19%). A altas temperaturas y alta presión, la solubilidad del SiO 2 aumenta. Su migración con vapor de agua también es posible, por lo que las pegmatitas de vetas hidrotermales se caracterizan por concentraciones significativas de cuarzo, que a menudo se asocia con elementos minerales (vetas de oro-cuarzo, cuarzo-cassiterita, etc.).
Propiedades físicas y químicas. C. forma cristales de color gris oscuro con brillo metálico, que tienen una red cúbica tipo diamante centrada en la cara con un punto A= 5,431 Å, densidad 2,33 gramos/cm3. A presiones muy altas se obtuvo una nueva modificación (aparentemente hexagonal) con una densidad de 2,55. gramos/cm3. K. se funde a 1417°C, hierve a 2600°C. Capacidad calorífica específica (a 20-100°C) 800 j/(kg× A), o 0,191 California/(GRAMO× granizo); La conductividad térmica incluso para las muestras más puras no es constante y está en el rango (25°C) 84-126. Mar/(metro× A), o 0,20-0,30 California/(cm× segundo× granizo). Coeficiente de temperatura de expansión lineal 2,33×10 -6 K -1 ; por debajo de 120K se vuelve negativo. K. es transparente a los rayos infrarrojos de onda larga; índice de refracción (para l =6 micras) 3,42; Constante dieléctrica 11.7. K. es diamagnético, la susceptibilidad magnética atómica es -0,13×10 -6. Dureza K según Mohs 7,0, según Brinell 2,4 Gn/m2 (240 kgf/mm2), módulo de elasticidad 109 Gn/m2 (10890 kgf/mm2), coeficiente de compresibilidad 0,325×10-6 cm 2 /kg. K. material quebradizo; Una deformación plástica notable comienza a temperaturas superiores a 800°C.
K. es un semiconductor que cada vez se utiliza más. Las propiedades eléctricas del cobre dependen en gran medida de las impurezas. La resistividad eléctrica volumétrica específica intrínseca de una celda a temperatura ambiente se considera 2,3 × 10 3 ohm× metro(2,3×10 5 ohm× cm).
Circuito semiconductor con conductividad. R-tipo (aditivos B, Al, In o Ga) y norte-tipo (aditivos P, Bi, As o Sb) tiene una resistencia significativamente menor. La banda prohibida según mediciones eléctricas es 1,21 ev en 0 A y disminuye a 1.119 ev a 300 A.
De acuerdo con la posición del anillo en la tabla periódica de Mendeleev, los 14 electrones del átomo del anillo se distribuyen en tres capas: en la primera (desde el núcleo) 2 electrones, en la segunda 8, en la tercera (valencia) 4; configuración de la capa de electrones 1s 2 2s 2 2p 6 3s 2 3p 2(cm. Átomo). Potenciales de ionización sucesivos ( ev): 8,149; 16,34; 33.46 y 45.13. Radio atómico 1,33 Å, radio covalente 1,17 Å, radios iónicos Si 4+ 0,39 Å, Si 4- 1,98 Å.
En compuestos de carbono (similares al carbono) 4-valentene. Sin embargo, a diferencia del carbono, la sílice, junto con un número de coordinación de 4, presenta un número de coordinación de 6, lo que se explica por el gran volumen de su átomo (un ejemplo de tales compuestos son los silicofluoruros que contienen el grupo 2).
El enlace químico de un átomo de carbono con otros átomos suele realizarse mediante orbitales híbridos sp 3, pero también es posible involucrar a dos de sus cinco (vacantes) 3. d- orbitales, especialmente cuando K. tiene seis coordenadas. Al tener un valor de electronegatividad bajo de 1,8 (frente a 2,5 para el carbono; 3,0 para el nitrógeno, etc.), el carbono es electropositivo en compuestos con no metales, y estos compuestos son de naturaleza polar. Alta energía de unión con oxígeno Si-O, igual a 464 kJ/mol(111 kcal/mol), determina la estabilidad de sus compuestos oxigenados (SiO 2 y silicatos). La energía del enlace Si-Si es baja, 176 kJ/mol (42 kcal/mol); A diferencia del carbono, el silicio no se caracteriza por la formación de largas cadenas y dobles enlaces entre átomos de Si. En el aire, debido a la formación de una película protectora de óxido, el carbono es estable incluso a temperaturas elevadas. En oxígeno se oxida a partir de 400°C, formando dióxido de silicio SiO2. También se conoce monóxido de SiO, estable a altas temperaturas en forma de gas; como resultado de un enfriamiento repentino, se puede obtener un producto sólido que se descompone fácilmente en una mezcla fina de Si y SiO 2. K. es resistente a los ácidos y se disuelve solo en una mezcla de ácidos nítrico y fluorhídrico; Se disuelve fácilmente en soluciones alcalinas calientes con liberación de hidrógeno. K. reacciona con flúor a temperatura ambiente, con otros halógenos cuando se calienta para formar compuestos de fórmula general SiX 4 (ver. Halogenuros de silicio). El hidrógeno no reacciona directamente con el carbono y ácidos silícicos(silanos) se obtienen por descomposición de siliciuros (ver más abajo). Las siliconas de hidrógeno se conocen desde SiH 4 hasta Si 8 H 18 (la composición es similar a la de los hidrocarburos saturados). K. forma 2 grupos de silanos que contienen oxígeno - siloxanos y siloxenos. El K reacciona con el nitrógeno a temperaturas superiores a 1000°C. De gran importancia práctica es el nitruro de Si 3 N 4, que no se oxida en el aire incluso a 1200°C, es resistente a los ácidos (excepto nítrico) y álcalis, así como a los metales fundidos y escorias, lo que lo convierte en un material valioso para la industria química, para la producción de refractarios, etc. Los compuestos de carbono con carbono se distinguen por su alta dureza, así como por su resistencia térmica y química ( carburo de silicio SiC) y con boro (SiB 3, SiB 6, SiB 12). Cuando se calienta, el cloro reacciona (en presencia de catalizadores metálicos, como el cobre) con compuestos organoclorados (por ejemplo, CH 3 Cl) para formar organohalosilanos [por ejemplo, Si (CH 3) 3 CI], que se utilizan para la síntesis. de numerosos compuestos organosilícicos.
K. forma compuestos con casi todos los metales. siliciuros(No se detectaron compuestos únicamente con Bi, Tl, Pb, Hg). Se han obtenido más de 250 siliciuros cuya composición (MeSi, MeSi 2, Me 5 Si 3, Me 3 Si, Me 2 Si, etc.) no suele corresponder a las valencias clásicas. Los siliciuros son refractarios y duros; El ferrosilicio es de gran importancia práctica (un agente reductor en la fundición de aleaciones especiales, ver Ferroaleaciones) y siliciuro de molibdeno MoSi 2 (calentadores de hornos eléctricos, álabes de turbinas de gas, etc.).
Recibo y solicitud. K. de pureza técnica (95-98%) se obtiene en un arco eléctrico mediante la reducción de sílice SiO 2 entre electrodos de grafito. En relación con el desarrollo de la tecnología de semiconductores, se han desarrollado métodos para obtener cobre puro y especialmente puro, lo que requiere la síntesis preliminar de los compuestos de partida más puros del cobre, de los cuales se extrae el cobre mediante reducción o descomposición térmica.
El cobre semiconductor puro se obtiene en dos formas: policristalino (mediante reducción de SiCI 4 o SiHCl 3 con zinc o hidrógeno, descomposición térmica de Sil 4 y SiH 4) y monocristalino (zona libre de crisol que funde y “tira” de un monocristal a partir de cobre fundido (método Czochralski).
El cobre especialmente dopado se utiliza ampliamente como material para la fabricación de dispositivos semiconductores (transistores, termistores, rectificadores de potencia, diodos controlados - tiristores; fotocélulas solares utilizadas en naves espaciales, etc.). Dado que K. es transparente a los rayos con longitudes de onda de 1 a 9 µm, se utiliza en óptica infrarroja (ver también Cuarzo).
K. tiene áreas de aplicación diversas y en constante expansión. En metalurgia, el oxígeno se utiliza para eliminar el oxígeno disuelto en los metales fundidos (desoxidación). K. es un componente de una gran cantidad de aleaciones de hierro y metales no ferrosos. Por lo general, el carbono confiere a las aleaciones una mayor resistencia a la corrosión, mejora sus propiedades de fundición y aumenta la resistencia mecánica; sin embargo, con un mayor contenido de K. puede provocar fragilidad. Las más importantes son las aleaciones de hierro, cobre y aluminio que contienen calcio. Se utiliza una cantidad cada vez mayor de carbono para la síntesis de compuestos organosilícicos y siliciuros. La sílice y muchos silicatos (arcillas, feldespatos, mica, talco, etc.) son procesados por las industrias del vidrio, el cemento, la cerámica, la eléctrica y otras.
V. P. Barzakovsky.
El silicio se encuentra en el organismo en forma de diversos compuestos, implicados principalmente en la formación de partes y tejidos esqueléticos duros. Algunas plantas marinas (por ejemplo, diatomeas) y animales (por ejemplo, esponjas silíceas, radiolarios) pueden acumular cantidades especialmente grandes de silicio, formando espesos depósitos de dióxido de silicio en el fondo del océano cuando mueren. En los mares y lagos fríos predominan los limos biogénicos enriquecidos en potasio, en los mares tropicales predominan los limos calcáreos con bajo contenido de potasio, entre las plantas terrestres, los cereales, juncos, palmeras y colas de caballo acumulan mucho potasio. En los vertebrados, el contenido de dióxido de silicio en las cenizas es del 0,1 al 0,5%. En mayores cantidades, K. se encuentra en el tejido conectivo denso, los riñones y el páncreas. La dieta humana diaria contiene hasta 1 GRAMO K. Cuando hay un alto contenido de polvo de dióxido de silicio en el aire, ingresa a los pulmones humanos y causa enfermedades. silicosis.
V. V. Kovalsky.
Iluminado.: Berezhnoy A.S., El silicio y sus sistemas binarios. K., 1958; Krasyuk B. A., Gribov A. I., Semiconductores: germanio y silicio, M., 1961; Renyan V.R., Tecnología del silicio semiconductor, trad. Del inglés, M., 1969; Sally I.V., Falkevich E.S., Producción de silicio semiconductor, M., 1970; Silicio y germanio. Se sentó. Arte., ed. E. S. Falkevich, D. I. Levinzon, V. 1-2, M., 1969-70; Gladyshevsky E.I., Química cristalina de siliciuros y germanuros, M., 1971; Wolf N. F., Datos de semiconductores de silicio, Oxf. - Nueva York, 1965.
Ver también: Lista de elementos químicos por número atómico y Lista alfabética de elementos químicos Contenido 1 Símbolos utilizados actualmente ... Wikipedia
Ver también: Lista de elementos químicos por símbolo y Lista alfabética de elementos químicos Esta es una lista de elementos químicos ordenados en orden creciente de número atómico. La tabla muestra el nombre del elemento, símbolo, grupo y período en... ... Wikipedia
- (ISO 4217) Códigos para la representación de monedas y fondos (inglés) Códigos pour la représentation des monnaies ettypes de fonds (francés) ... Wikipedia
La forma más simple de materia que puede identificarse mediante métodos químicos. Son componentes de sustancias simples y complejas, que representan un conjunto de átomos con la misma carga nuclear. La carga del núcleo de un átomo está determinada por el número de protones que tiene... Enciclopedia de Collier
Contenidos 1 Era Paleolítica 2 X milenio antes de Cristo. mi. 3 IX milenio antes de Cristo Eh... Wikipedia
Contenidos 1 Era Paleolítica 2 X milenio antes de Cristo. mi. 3 IX milenio antes de Cristo Eh... Wikipedia
Este término tiene otros significados, consulte Ruso (significados). Rusos... Wikipedia
Terminología 1: : dw Número del día de la semana. “1” corresponde al lunes Definiciones del término de varios documentos: dw DUT La diferencia entre la hora de Moscú y UTC, expresada como un número entero de horas Definiciones del término de... ... Diccionario-libro de referencia de términos de documentación normativa y técnica.
¿Cómo utilizar la tabla periódica? Para un no iniciado, leer la tabla periódica es lo mismo que para un gnomo observar las antiguas runas de los elfos. Y la tabla periódica puede decirte mucho sobre el mundo.
Además de ser de gran utilidad en el examen, también es simplemente insustituible para resolver una gran cantidad de problemas químicos y físicos. ¿Pero cómo leerlo? Afortunadamente, hoy todo el mundo puede aprender este arte. En este artículo te contamos cómo entender la tabla periódica.
La tabla periódica de elementos químicos (tabla de Mendeleev) es una clasificación de elementos químicos que establece la dependencia de diversas propiedades de los elementos de la carga del núcleo atómico.
Historia de la creación de la Mesa.
Dmitry Ivanovich Mendeleev no era un simple químico, si alguien lo cree así. Fue químico, físico, geólogo, metrólogo, ecologista, economista, petrolero, aeronauta, fabricante de instrumentos y docente. Durante su vida, el científico logró realizar una gran cantidad de investigaciones fundamentales en diversos campos del conocimiento. Por ejemplo, se cree ampliamente que fue Mendeleev quien calculó la concentración ideal del vodka: 40 grados.
No sabemos qué opinaba Mendeleev del vodka, pero sabemos con seguridad que su disertación sobre el tema "El discurso sobre la combinación de alcohol con agua" no tenía nada que ver con el vodka y consideraba concentraciones de alcohol a partir de 70 grados. Con todos los méritos del científico, el descubrimiento de la ley periódica de los elementos químicos, una de las leyes fundamentales de la naturaleza, le dio la mayor fama.

Existe una leyenda según la cual un científico soñó con la tabla periódica y después de lo cual sólo tuvo que perfeccionar la idea que le había aparecido. Pero, si todo fuera tan simple... Esta versión de la creación de la tabla periódica, aparentemente, no es más que una leyenda. Cuando se le preguntó cómo se abrió la mesa, el propio Dmitry Ivanovich respondió: “ He estado pensando en ello durante unos veinte años, pero piensas: estaba sentado allí y de repente... ya está hecho”.
A mediados del siglo XIX, varios científicos intentaron en paralelo ordenar los elementos químicos conocidos (se conocían 63 elementos). Por ejemplo, en 1862, Alexandre Emile Chancourtois colocó elementos a lo largo de una hélice y observó la repetición cíclica de propiedades químicas.
El químico y músico John Alexander Newlands propuso su versión de la tabla periódica en 1866. Lo interesante es que el científico intentó descubrir algún tipo de armonía musical mística en la disposición de los elementos. Entre otros intentos, también estuvo el intento de Mendeleev, que se vio coronado por el éxito.

En 1869 se publicó el primer diagrama de tabla y se considera el 1 de marzo de 1869 el día en que se inauguró la ley periódica. La esencia del descubrimiento de Mendeleev fue que las propiedades de los elementos con una masa atómica creciente no cambian de forma monótona, sino periódica.
La primera versión de la tabla contenía sólo 63 elementos, pero Mendeleev tomó una serie de decisiones muy poco convencionales. Entonces, supuso dejar espacio en la tabla para elementos aún no descubiertos y también cambió las masas atómicas de algunos elementos. La exactitud fundamental de la ley derivada de Mendeleev se confirmó muy pronto, después del descubrimiento del galio, el escandio y el germanio, cuya existencia fue predicha por el científico.
Vista moderna de la tabla periódica.
A continuación se muestra la tabla en sí.

Hoy en día, en lugar del peso atómico (masa atómica), se utiliza el concepto de número atómico (el número de protones en el núcleo) para ordenar los elementos. La tabla contiene 120 elementos, que están ordenados de izquierda a derecha en orden creciente de número atómico (número de protones)
Las columnas de la tabla representan los llamados grupos y las filas representan períodos. La tabla tiene 18 grupos y 8 periodos.
- Las propiedades metálicas de los elementos disminuyen cuando se mueven a lo largo de un período de izquierda a derecha y aumentan en la dirección opuesta.
- Los tamaños de los átomos disminuyen cuando se mueven de izquierda a derecha a lo largo de los períodos.
- A medida que se avanza de arriba a abajo a través del grupo, las propiedades reductoras del metal aumentan.
- Las propiedades oxidantes y no metálicas aumentan a medida que se avanza en un período de izquierda a derecha.
¿Qué aprendemos sobre un elemento de la tabla? Por ejemplo, tomemos el tercer elemento de la tabla, el litio, y consideremoslo en detalle.

En primer lugar, vemos el símbolo del elemento en sí y su nombre debajo. En la esquina superior izquierda está el número atómico del elemento, en cuyo orden está ordenado el elemento en la tabla. El número atómico, como ya se mencionó, es igual al número de protones en el núcleo. El número de protones positivos suele ser igual al número de electrones negativos en un átomo (excepto en los isótopos).
La masa atómica se indica debajo del número atómico (en esta versión de la tabla). Si redondeamos la masa atómica al número entero más cercano, obtenemos lo que se llama número másico. La diferencia entre el número másico y el número atómico da el número de neutrones en el núcleo. Así, el número de neutrones en un núcleo de helio es dos y en el de litio es cuatro.
Nuestro curso “Tabla periódica para principiantes” ha finalizado. En conclusión, lo invitamos a ver un video temático y esperamos que la cuestión de cómo utilizar la tabla periódica de Mendeleev le haya quedado más clara. Te recordamos que siempre es más eficaz estudiar un tema nuevo no solo, sino con la ayuda de un mentor experimentado. Por eso nunca debes olvidarte del servicio de estudiantes, que estará encantado de compartir contigo sus conocimientos y experiencias.