Nazwy wszystkich pierwiastków chemicznych układu okresowego. Alfabetyczna lista pierwiastków chemicznych
Jeśli uważasz, że układ okresowy jest dla Ciebie trudny do zrozumienia, nie jesteś sam! Chociaż zrozumienie jego zasad może być trudne, nauczenie się, jak z niego korzystać, pomoże ci w studiowaniu przedmiotów ścisłych. Najpierw przestudiuj strukturę tabeli i jakich informacji możesz się z niej dowiedzieć o każdym pierwiastku chemicznym. Następnie możesz zacząć badać właściwości każdego elementu. I wreszcie, korzystając z układu okresowego, możesz określić liczbę neutronów w atomie określonego pierwiastka chemicznego.
Kroki
Część 1
Struktura tabeli-
Jak widać, każdy kolejny element zawiera o jeden proton więcej niż element go poprzedzający. Jest to oczywiste, gdy spojrzymy na liczby atomowe. Liczby atomowe zwiększają się o jeden w miarę przesuwania się od lewej do prawej. Ponieważ elementy są ułożone w grupy, niektóre komórki tabeli pozostają puste.
- Na przykład pierwszy wiersz tabeli zawiera wodór o liczbie atomowej 1 i hel o liczbie atomowej 2. Znajdują się one jednak na przeciwległych krawędziach, ponieważ należą do różnych grup.
-
Dowiedz się o grupach zawierających pierwiastki o podobnych właściwościach fizycznych i chemicznych. Elementy każdej grupy znajdują się w odpowiedniej kolumnie pionowej. Zazwyczaj są one identyfikowane tym samym kolorem, co pomaga zidentyfikować pierwiastki o podobnych właściwościach fizycznych i chemicznych oraz przewidzieć ich zachowanie. Wszystkie pierwiastki danej grupy mają tę samą liczbę elektronów na swojej powłoce zewnętrznej.
- Wodór można sklasyfikować zarówno jako metale alkaliczne, jak i halogeny. W niektórych tabelach jest to wskazane w obu grupach.
- W większości przypadków grupy są ponumerowane od 1 do 18, a liczby umieszczane są na górze lub na dole tabeli. Liczby można podawać cyframi rzymskimi (np. IA) lub arabskimi (np. 1A lub 1).
- Mówi się, że poruszając się po kolumnie od góry do dołu, „przeglądasz grupę”.
-
Dowiedz się, dlaczego w tabeli są puste komórki. Pierwiastki uporządkowane są nie tylko według liczby atomowej, ale także według grup (pierwiastki z tej samej grupy mają podobne właściwości fizyczne i chemiczne). Dzięki temu łatwiej jest zrozumieć jak zachowuje się dany element. Jednak wraz ze wzrostem liczby atomowej nie zawsze można znaleźć elementy należące do odpowiedniej grupy, dlatego w tabeli pozostają puste komórki.
- Na przykład pierwsze 3 rzędy mają puste komórki, ponieważ metale przejściowe występują tylko o liczbie atomowej 21.
- Pierwiastki o liczbach atomowych od 57 do 102 są klasyfikowane jako pierwiastki ziem rzadkich i zwykle są umieszczane w osobnej podgrupie w prawym dolnym rogu tabeli.
-
Każdy wiersz tabeli reprezentuje kropkę. Wszystkie pierwiastki tego samego okresu mają tę samą liczbę orbitali atomowych, na których znajdują się elektrony w atomach. Liczba orbitali odpowiada numerowi okresu. Tabela zawiera 7 wierszy, czyli 7 okresów.
- Na przykład atomy pierwiastków pierwszego okresu mają jeden orbital, a atomy pierwiastków siódmego okresu mają 7 orbitali.
- Z reguły okresy są oznaczone cyframi od 1 do 7 po lewej stronie tabeli.
- Mówi się, że przesuwając się wzdłuż linii od lewej do prawej, „przeglądasz kropkę”.
-
Naucz się rozróżniać metale, metaloidy i niemetale. Lepiej zrozumiesz właściwości elementu, jeśli potrafisz określić, jaki to jest typ. Dla wygody w większości tabel metale, metaloidy i niemetale są oznaczone różnymi kolorami. Metale znajdują się po lewej stronie, a niemetale po prawej stronie stołu. Pomiędzy nimi znajdują się metaloidy.
Część 2
Oznaczenia elementów-
Każdy element jest oznaczony jedną lub dwiema literami łacińskimi. Z reguły symbol elementu jest wyświetlany dużymi literami pośrodku odpowiedniej komórki. Symbol to skrócona nazwa elementu, która jest taka sama w większości języków. Symbole pierwiastków są powszechnie używane podczas przeprowadzania eksperymentów i pracy z równaniami chemicznymi, dlatego warto je zapamiętać.
- Zazwyczaj symbole elementów są skrótami ich nazw łacińskich, chociaż w przypadku niektórych, szczególnie niedawno odkrytych elementów, wywodzą się one od nazwy zwyczajowej. Na przykład hel jest reprezentowany przez symbol He, który jest zbliżony do nazwy zwyczajowej w większości języków. Jednocześnie żelazo oznacza się jako Fe, co jest skrótem od jego łacińskiej nazwy.
-
Zwróć uwagę na pełną nazwę elementu, jeśli jest ona podana w tabeli. Ten element „nazwa” jest używany w zwykłych tekstach. Na przykład „hel” i „węgiel” to nazwy pierwiastków. Zwykle, chociaż nie zawsze, pełne nazwy pierwiastków są wymienione poniżej ich symboli chemicznych.
- Czasami tabela nie wskazuje nazw pierwiastków, a jedynie podaje ich symbole chemiczne.
-
Znajdź liczbę atomową. Zwykle liczba atomowa pierwiastka znajduje się na górze odpowiedniej komórki, pośrodku lub w rogu. Może również pojawić się pod symbolem lub nazwą elementu. Pierwiastki mają liczby atomowe od 1 do 118.
- Liczba atomowa jest zawsze liczbą całkowitą.
-
Pamiętaj, że liczba atomowa odpowiada liczbie protonów w atomie. Wszystkie atomy pierwiastka zawierają tę samą liczbę protonów. W przeciwieństwie do elektronów liczba protonów w atomach pierwiastka pozostaje stała. W przeciwnym razie otrzymasz inny pierwiastek chemiczny!
- Liczba atomowa pierwiastka może również określać liczbę elektronów i neutronów w atomie.
-
Zwykle liczba elektronów jest równa liczbie protonów. Wyjątkiem jest przypadek, gdy atom jest zjonizowany. Protony mają ładunek dodatni, a elektrony ładunek ujemny. Ponieważ atomy są zwykle obojętne, zawierają tę samą liczbę elektronów i protonów. Jednakże atom może zyskać lub stracić elektrony, w takim przypadku ulega jonizacji.
- Jony mają ładunek elektryczny. Jeśli jon ma więcej protonów, ma ładunek dodatni i w takim przypadku po symbolu pierwiastka umieszcza się znak plus. Jeśli jon zawiera więcej elektronów, ma ładunek ujemny, oznaczony znakiem minus.
- Znaki plus i minus nie są używane, jeśli atom nie jest jonem.
-
Układ okresowy, czyli układ okresowy pierwiastków chemicznych, zaczyna się w lewym górnym rogu i kończy na końcu ostatniego wiersza układu (prawy dolny róg). Pierwiastki w tabeli ułożone są od lewej do prawej, w kolejności rosnącej według ich liczby atomowej. Liczba atomowa pokazuje, ile protonów znajduje się w jednym atomie. Ponadto wraz ze wzrostem liczby atomowej wzrasta również masa atomowa. Zatem na podstawie położenia pierwiastka w układzie okresowym można określić jego masę atomową.
Zobacz także: Lista pierwiastków chemicznych według liczby atomowej i Alfabetyczna lista pierwiastków chemicznych Spis treści 1 Aktualnie używane symbole ... Wikipedia
Zobacz także: Lista pierwiastków chemicznych według symboli i Alfabetyczna lista pierwiastków chemicznych. Jest to lista pierwiastków chemicznych ułożona w kolejności rosnącej liczby atomowej. Tabela pokazuje nazwę elementu, symbolu, grupy i okresu w... ...Wikipedii
Główny artykuł: Listy pierwiastków chemicznych Spis treści 1 Konfiguracja elektroniczna 2 Literatura 2.1 NIST ... Wikipedia
Główny artykuł: Wykazy pierwiastków chemicznych Nr Symbol Nazwa Twardość Mohsa Twardość Vickersa (GPa) Twardość Brinnella (GPa) 3 Li Lit 0,6 4 Be Beryl 5,5 1,67 0,6 5 B Bor 9,5 49 6 C Węgiel 1,5 (grafit) 6...Wikipedia
Zobacz także: Lista pierwiastków chemicznych według liczby atomowej i Lista pierwiastków chemicznych według symboli Alfabetyczna lista pierwiastków chemicznych. Azot N Aktyn Ac Aluminium Al Ameryk Am Argon Ar Astat W ... Wikipedia
Główny artykuł: Wykazy pierwiastków chemicznych Lp. Symbol Nazwa rosyjska Nazwa łacińska Etymologia nazwy 1 H Wodór Wodór Z innej greki. ὕδωρ „woda” i γεννάω „rodzę”. 2... Wikipedia
Lista symboli pierwiastków chemicznych to symbole (znaki), kody lub skróty używane do krótkiego lub wizualnego przedstawienia nazw pierwiastków chemicznych i prostych substancji o tej samej nazwie. Przede wszystkim są to symbole pierwiastków chemicznych… Wikipedia
Poniżej znajdują się nazwy błędnie odkrytych pierwiastków chemicznych (ze wskazaniem autorów i dat odkrycia). Wszystkie wymienione poniżej elementy zostały odkryte w wyniku eksperymentów przeprowadzonych mniej lub bardziej obiektywnie, ale zazwyczaj błędnie... ... Wikipedia
Na tych stronach zebrane są zalecane wartości dla wielu właściwości elementów, wraz z różnymi odniesieniami. Wszelkie zmiany wartości w infoboksie należy porównać z podanymi wartościami i/lub odpowiednio podać... ... Wikipedia
Symbol chemiczny cząsteczki dwuatomowego chloru 35 Symbole pierwiastków chemicznych (symbole chemiczne) symbol pierwiastków chemicznych. Razem ze wzorami chemicznymi, diagramami i równaniami reakcji chemicznych tworzą one język formalny... ...Wikipedię
Książki
- Słownik japońsko-angielsko-rosyjski dotyczący instalacji urządzeń przemysłowych. Około 8 000 terminów, Popova I.S.. Słownik przeznaczony jest dla szerokiego grona użytkowników, a przede wszystkim dla tłumaczy i specjalistów technicznych zajmujących się dostawą i wdrażaniem urządzeń przemysłowych z Japonii lub...
- Angielski dla lekarzy. 8 wyd. , Muraveyskaya Marianna Stepanovna, Orlova Larisa Konstantinovna. 384 s. Celem podręcznika jest nauka czytania i tłumaczenia tekstów medycznych z języka angielskiego, prowadzenie konwersacji z różnych dziedzin medycyny. Składa się z krótkiego wprowadzającego fonetycznego i...
Krzem(łac. Krzem), Si, pierwiastek chemiczny grupy IV układu okresowego Mendelejewa; liczba atomowa 14, masa atomowa 28,086. W naturze pierwiastek reprezentowany jest przez trzy stabilne izotopy: 28 Si (92,27%), 29 Si (4,68%) i 30 Si (3,05%).
Odniesienie historyczne. Związki K, szeroko rozpowszechnione na Ziemi, znane są człowiekowi już od epoki kamienia. Używanie narzędzi kamiennych do pracy i polowań trwało kilka tysiącleci. Zastosowanie związków K związane z ich przetwarzaniem – produkcją szkło- rozpoczął się około 3000 roku p.n.e. mi. (w starożytnym Egipcie). Najwcześniejszym znanym związkiem K. jest dwutlenek SiO2 (krzemionka). W XVIII wieku krzemionkę uważano za ciało proste i nazywano ją „ziemiami” (co znajduje odzwierciedlenie w jej nazwie). Złożoność składu krzemionki ustalił I. Ya. Berzelius. Po raz pierwszy w 1825 roku uzyskał krzem pierwiastkowy z fluorku krzemu SiF 4, redukując ten ostatni metalicznym potasem. Nowemu pierwiastkowi nadano nazwę „krzem” (od łacińskiego silex – krzemień). Rosyjska nazwa została wprowadzona przez G.I. Hess w 1834.
Występowanie w przyrodzie. Pod względem występowania w skorupie ziemskiej tlen jest drugim pierwiastkiem (po tlenie), jego średnia zawartość w litosferze wynosi 29,5% (masowo). W skorupie ziemskiej węgiel odgrywa tę samą podstawową rolę, co węgiel w świecie zwierząt i roślin. Dla geochemii tlenu istotne jest jego niezwykle silne połączenie z tlenem. Około 12% litosfery stanowi krzemionka SiO 2 w postaci minerału kwarc i jego odmiany. 75% litosfery składa się z różnych krzemiany I glinokrzemiany(skalenie, miki, amfibole itp.). Całkowita liczba minerałów zawierających krzemionkę przekracza 400 (patrz ryc. Minerały krzemionkowe).
Podczas procesów magmowych następuje słabe zróżnicowanie wapnia: gromadzi się on zarówno w granitoidach (32,3%), jak i w skałach ultrazasadowych (19%). W wysokich temperaturach i wysokim ciśnieniu rozpuszczalność SiO2 wzrasta. Możliwa jest także jego migracja z parą wodną, dlatego pegmatyty żył hydrotermalnych charakteryzują się znaczną koncentracją kwarcu, któremu często towarzyszą pierwiastki kruszcowe (żyły złoto-kwarcowe, kwarcowo-kasyterytowe itp.).
Fizyczne i chemiczne właściwości. C. tworzy ciemnoszare kryształy o metalicznym połysku, posiadające skupioną na powierzchni sześcienną siatkę typu diamentu z kropką A= 5,431 Å, gęstość 2,33 g/cm 3 . Przy bardzo wysokich ciśnieniach uzyskano nową (pozornie sześciokątną) modyfikację o gęstości 2,55 g/cm 3 . K. topi się w 1417°C, wrze w 2600°C. Ciepło właściwe (przy 20-100°C) 800 J/(kg× DO) lub 0,191 kal/(G× grad); przewodność cieplna nawet dla najczystszych próbek nie jest stała i mieści się w przedziale (25°C) 84-126 wt/(M× DO) lub 0,20-0,30 kal/(cm× sek× grad). Współczynnik temperaturowy rozszerzalności liniowej 2,33×10 -6 K -1 ; poniżej 120 K staje się ujemne. K. jest przezroczysty dla długofalowych promieni podczerwonych; współczynnik załamania światła (dla l =6 µm) 3,42; stała dielektryczna 11,7. K. jest diamagnetykiem, podatność magnetyczna atomu wynosi -0,13×10 -6. Twardość K według Mohsa 7,0, według Brinella 2,4 Gn/m 2 (240 kgf/mm2), moduł sprężystości 109 Gn/m 2 (10890 kgf/mm2), współczynnik ściśliwości 0,325×10 -6 cm 2 /kg. K. materiał kruchy; zauważalne odkształcenie plastyczne rozpoczyna się w temperaturach powyżej 800°C.
K. jest półprzewodnikiem, który znajduje coraz większe zastosowanie. Właściwości elektryczne miedzi w dużym stopniu zależą od zanieczyszczeń. Przyjmuje się, że wewnętrzna właściwa objętościowa oporność elektryczna ogniwa w temperaturze pokojowej wynosi 2,3 × 10 3 om× M(2,3×10 5 om× cm).
Obwód półprzewodnikowy z przewodnością R-typ (dodatki B, Al, In lub Ga) i N typu (dodatki P, Bi, As lub Sb) ma znacznie niższą odporność. Pasmo wzbronione według pomiarów elektrycznych wynosi 1,21 ew o 0 DO i spada do 1,119 ew o 300 DO.
Zgodnie z pozycją pierścienia w układzie okresowym Mendelejewa 14 elektronów atomu pierścienia jest rozmieszczonych na trzech powłokach: w pierwszej (z jądra) 2 elektrony, w drugiej 8, w trzeciej (wartościowość) 4; konfiguracja powłoki elektronowej 1s 2 2s 2 2p 6 3s 2 3p 2(cm. Atom). Kolejne potencjały jonizacji ( ew): 8,149; 16.34; 33,46 i 45,13. Promień atomowy 1,33 Å, promień kowalencyjny 1,17 Å, promienie jonowe Si 4+ 0,39 Å, Si 4- 1,98 Å.
W związkach węgla (podobnych do węgla) 4-walenten. Jednakże w przeciwieństwie do węgla, krzemionka wraz z liczbą koordynacyjną 4 wykazuje liczbę koordynacyjną 6, co tłumaczy się dużą objętością jej atomu (przykładem takich związków są krzemofluorki zawierające grupę 2-).
Wiązanie chemiczne atomu węgla z innymi atomami zwykle odbywa się za pomocą hybrydowych orbitali sp 3, ale możliwe jest również zaangażowanie dwóch z pięciu (wolnych) 3 D- orbitale, zwłaszcza gdy K. ma sześć współrzędnych. Mając niską wartość elektroujemności wynoszącą 1,8 (w porównaniu z 2,5 dla węgla; 3,0 dla azotu itp.), węgiel jest elektrododatni w związkach z niemetalami, a związki te mają charakter polarny. Wysoka energia wiązania z tlenem Si-O, równa 464 kJ/mol(111 kcal/mol), określa stabilność jego związków tlenowych (SiO 2 i krzemiany). Energia wiązania Si-Si jest niska, 176 kJ/mol (42 kcal/mol); W przeciwieństwie do węgla, krzem nie charakteryzuje się tworzeniem długich łańcuchów i podwójnych wiązań pomiędzy atomami Si. W powietrzu, dzięki utworzeniu ochronnej warstwy tlenkowej, węgiel jest stabilny nawet w podwyższonych temperaturach. W tlenie utlenia się już w temperaturze 400°C, tworząc dwutlenek krzemu SiO2. Znany jest także monotlenek SiO, stabilny w wysokich temperaturach w postaci gazu; w wyniku nagłego ochłodzenia można otrzymać produkt stały, który łatwo rozkłada się na cienką mieszaninę Si i SiO2. K. jest odporny na kwasy i rozpuszcza się tylko w mieszaninie kwasu azotowego i fluorowodorowego; łatwo rozpuszcza się w gorących roztworach alkalicznych z wydzieleniem wodoru. K. reaguje z fluorem w temperaturze pokojowej, z innymi halogenami po podgrzaniu, tworząc związki o ogólnym wzorze SiX 4 (patrz. Halogenki krzemu). Wodór nie reaguje bezpośrednio z węglem i kwasy krzemowe(silany) otrzymuje się w wyniku rozkładu krzemków (patrz poniżej). Silikony wodorowe znane są z SiH 4 do Si 8 H 18 (skład jest podobny do węglowodorów nasyconych). K. tworzy 2 grupy silanów zawierających tlen - siloksany i silokseny. K reaguje z azotem w temperaturach powyżej 1000°C. Duże znaczenie praktyczne ma azotek Si 3 N 4, który nie utlenia się na powietrzu już w temperaturze 1200°C, jest odporny na kwasy (oprócz azotu) i zasady, a także roztopione metale i żużle, co czyni go cennym materiałem do przemyśle chemicznym, do produkcji materiałów ogniotrwałych itp. Związki węgla z węglem wyróżniają się dużą twardością oraz odpornością termiczną i chemiczną ( węglik krzemu SiC) i borem (SiB 3, SiB 6, SiB 12). Po podgrzaniu chlor reaguje (w obecności katalizatorów metalicznych, takich jak miedź) ze związkami chloroorganicznymi (na przykład CH 3 Cl), tworząc organohalosilany [na przykład Si (CH 3) 3 CI], które są wykorzystywane do syntezy z wielu związki krzemoorganiczne.
K. tworzy związki z prawie wszystkimi metalami - krzemki(nie wykryto związków zawierających wyłącznie Bi, Tl, Pb, Hg). Otrzymano ponad 250 krzemków, których skład (MeSi, MeSi 2, Me 5 Si 3, Me 3 Si, Me 2 Si itp.) zwykle nie odpowiada klasycznym wartościowościom. Krzemki są ogniotrwałe i twarde; Największe znaczenie praktyczne ma żelazokrzem (czynnik redukujący przy wytapianiu stopów specjalnych, zob Żelazostopy) i krzemek molibdenu MoSi 2 (grzejniki pieców elektrycznych, łopatki turbin gazowych itp.).
Odbiór i wniosek. K. o czystości technicznej (95-98%) otrzymuje się w łuku elektrycznym poprzez redukcję krzemionki SiO2 pomiędzy elektrodami grafitowymi. W związku z rozwojem technologii półprzewodników opracowano metody otrzymywania czystej, a szczególnie czystej miedzi, co wymaga wstępnej syntezy najczystszych wyjściowych związków miedzi, z których miedź ekstrahuje się poprzez redukcję lub rozkład termiczny.
Czystą miedź półprzewodnikową otrzymuje się w dwóch postaciach: polikrystaliczną (poprzez redukcję SiCl 4 lub SiHCl 3 cynkiem lub wodorem, termiczny rozkład Sil 4 i SiH 4) oraz monokrystaliczną (beztyglowe topienie strefy i „wyciąganie” monokryształu ze stopionej miedzi – metoda Czochralskiego).
Specjalnie domieszkowana miedź jest szeroko stosowana jako materiał do produkcji urządzeń półprzewodnikowych (tranzystory, termistory, prostowniki mocy, diody sterowane - tyrystory, fotokomórki słoneczne stosowane w statkach kosmicznych itp.). Ponieważ K. jest przezroczysty dla promieni o długości fali od 1 do 9 µm, jest stosowany w optyce podczerwieni (patrz także Kwarc).
K. ma różnorodne i stale poszerzające się obszary zastosowań. W metalurgii tlen służy do usuwania tlenu rozpuszczonego w stopionych metalach (odtlenianie). K. jest składnikiem wielu stopów żelaza i metali nieżelaznych. Zwykle węgiel nadaje stopom zwiększoną odporność na korozję, poprawia ich właściwości odlewnicze i zwiększa wytrzymałość mechaniczną; jednakże przy wyższej zawartości K. może powodować kruchość. Do najważniejszych należą stopy żelaza, miedzi i aluminium zawierające wapń.Coraz coraz więcej węgla wykorzystuje się do syntezy związków krzemoorganicznych i krzemków. Krzemionka i wiele krzemianów (glinki, skalenie, mika, talk itp.) są przetwarzane w przemyśle szklarskim, cementowym, ceramicznym, elektrycznym i innych.
V. P. Barzakovsky.
Krzem występuje w organizmie w postaci różnych związków, biorących udział głównie w tworzeniu twardych części szkieletu i tkanek. Niektóre rośliny morskie (na przykład okrzemki) i zwierzęta (na przykład gąbki krzemionkowe, radiolarie) mogą gromadzić szczególnie duże ilości krzemu, tworząc po śmierci grube osady dwutlenku krzemu na dnie oceanu. W zimnych morzach i jeziorach dominują muły biogeniczne wzbogacone w potas, w morzach tropikalnych przeważają muły wapienne o niskiej zawartości potasu. Wśród roślin lądowych duże ilości potasu gromadzą zboża, turzyce, palmy i skrzypy. U kręgowców zawartość dwutlenku krzemu w substancjach popiołowych wynosi 0,1-0,5%. W największych ilościach K. występuje w gęstej tkance łącznej, nerkach i trzustce. Codzienna dieta człowieka zawiera do 1 G K. Gdy w powietrzu występuje duża zawartość pyłu dwutlenku krzemu, przedostaje się on do płuc człowieka i powoduje choroby - krzemica.
V. V. Kowalski.
Oświetlony.: Berezhnoy A.S., Krzem i jego systemy binarne. K., 1958; Krasyuk B. A., Gribov A. I., Półprzewodniki - german i krzem, M., 1961; Renyan V.R., Technologia krzemu półprzewodnikowego, przeł. z języka angielskiego, M., 1969; Sally I.V., Falkevich E.S., Produkcja krzemu półprzewodnikowego, M., 1970; Krzem i german. sob. Sztuka, wyd. E. S. Falkevich, D. I. Levinzon, V. 1-2, M., 1969-70; Gladyshevsky E.I., Chemia krystaliczna krzemków i germanków, M., 1971; Wolf N. F., Dane dotyczące półprzewodników krzemowych, Oxf. - Nowy Jork, 1965.
Zobacz także: Lista pierwiastków chemicznych według liczby atomowej i Alfabetyczna lista pierwiastków chemicznych Spis treści 1 Aktualnie używane symbole ... Wikipedia
Zobacz także: Lista pierwiastków chemicznych według symboli i Alfabetyczna lista pierwiastków chemicznych. Jest to lista pierwiastków chemicznych ułożona w kolejności rosnącej liczby atomowej. Tabela pokazuje nazwę elementu, symbolu, grupy i okresu w... ...Wikipedii
- (ISO 4217) Kody reprezentacji walut i funduszy (angielski) Codes pour la représentation des monnaies et types de fonds (francuski) ... Wikipedia
Najprostsza forma materii, którą można zidentyfikować metodami chemicznymi. Są to składniki substancji prostych i złożonych, reprezentujące zbiór atomów o tym samym ładunku jądrowym. Ładunek jądra atomowego zależy od liczby protonów w... Encyklopedia Colliera
Spis treści 1 Epoka paleolitu 2 X tysiąclecie p.n.e. mi. 3 IX tysiąclecie p.n.e ech... Wikipedia
Spis treści 1 Epoka paleolitu 2 X tysiąclecie p.n.e. mi. 3 IX tysiąclecie p.n.e ech... Wikipedia
Termin ten ma inne znaczenia, patrz rosyjski (znaczenia). Rosjanie... Wikipedia
Terminologia 1: : dw Numer dnia tygodnia. „1” odpowiada poniedziałkowi. Definicje terminu z różnych dokumentów: dw DUT Różnica między czasem moskiewskim a czasem UTC, wyrażona jako całkowita liczba godzin. Definicje terminu z ... ... Słownik-podręcznik terminów dokumentacji normatywnej i technicznej
Jak korzystać z układu okresowego? Dla niewtajemniczonej osoby czytanie układu okresowego jest takie samo, jak dla gnoma przeglądającego starożytne runy elfów. A układ okresowy może wiele powiedzieć o świecie.
Oprócz tego, że dobrze posłuży na egzaminie, jest też po prostu niezastąpiony w rozwiązywaniu ogromnej liczby problemów chemicznych i fizycznych. Ale jak to przeczytać? Na szczęście dziś każdy może nauczyć się tej sztuki. W tym artykule dowiemy się, jak rozumieć układ okresowy.
Układ okresowy pierwiastków chemicznych (tablica Mendelejewa) to klasyfikacja pierwiastków chemicznych, która ustala zależność różnych właściwości pierwiastków od ładunku jądra atomowego.
Historia powstania Tabeli
Dmitrij Iwanowicz Mendelejew nie był prostym chemikiem, jeśli ktoś tak sądzi. Był chemikiem, fizykiem, geologiem, metrologiem, ekologiem, ekonomistą, naftowcem, aeronautą, konstruktorem instrumentów i nauczycielem. W ciągu swojego życia naukowcowi udało się przeprowadzić wiele podstawowych badań z różnych dziedzin wiedzy. Na przykład powszechnie uważa się, że to Mendelejew obliczył idealną moc wódki - 40 stopni.
Nie wiemy, co Mendelejew myślał o wódce, ale wiemy na pewno, że jego rozprawa na temat „Dyskurs o połączeniu alkoholu z wodą” nie miała nic wspólnego z wódką i uwzględniała stężenia alkoholu od 70 stopni. Przy wszystkich zasługach naukowca największą sławę przyniosło mu odkrycie okresowego prawa pierwiastków chemicznych - jednego z podstawowych praw natury.

Istnieje legenda, według której naukowcowi przyśnił się układ okresowy, po czym musiał już tylko udoskonalić pomysł, który się pojawił. Ale gdyby wszystko było takie proste.. Ta wersja stworzenia układu okresowego najwyraźniej jest niczym więcej niż legendą. Na pytanie, jak otwarto stół, sam Dmitrij Iwanowicz odpowiedział: „ Myślałem o tym może od dwudziestu lat, a ty myślisz: siedziałem i nagle… gotowe”.
W połowie XIX wieku próby uporządkowania znanych pierwiastków chemicznych (znanych było 63 pierwiastki) podejmowało równolegle kilku naukowców. Na przykład w 1862 roku Alexandre Emile Chancourtois umieścił pierwiastki wzdłuż helisy i zauważył cykliczne powtarzanie się właściwości chemicznych.
Chemik i muzyk John Alexander Newlands zaproponował swoją wersję układu okresowego w 1866 roku. Ciekawostką jest to, że naukowiec próbował odkryć jakąś mistyczną harmonię muzyczną w układzie elementów. Była między innymi próba Mendelejewa, która zakończyła się sukcesem.

W 1869 roku opublikowano pierwszy diagram tablicowy, a za dzień otwarcia prawa okresowego uważa się 1 marca 1869 roku. Istotą odkrycia Mendelejewa było to, że właściwości pierwiastków wraz ze wzrostem masy atomowej nie zmieniają się monotonicznie, ale okresowo.
Pierwsza wersja tabeli zawierała tylko 63 elementy, ale Mendelejew podjął szereg bardzo niekonwencjonalnych decyzji. Domyślił się więc, aby zostawić miejsce w tabeli na wciąż nieodkryte pierwiastki, a także zmienił masy atomowe niektórych pierwiastków. Zasadnicza poprawność prawa wyprowadzonego przez Mendelejewa została potwierdzona bardzo szybko, po odkryciu galu, skandu i germanu, których istnienie przepowiadał uczony.
Współczesne spojrzenie na układ okresowy
Poniżej znajduje się sama tabela

Obecnie zamiast masy atomowej (masy atomowej) do porządkowania pierwiastków używa się pojęcia liczby atomowej (liczby protonów w jądrze). Tabela zawiera 120 elementów, które ułożone są od lewej do prawej w kolejności rosnącej liczby atomowej (liczby protonów)
Kolumny tabeli reprezentują tzw. grupy, a wiersze reprezentują okresy. Tabela ma 18 grup i 8 okresów.
- Właściwości metaliczne pierwiastków zmniejszają się podczas przemieszczania się w okresie od lewej do prawej i rosną w przeciwnym kierunku.
- Rozmiary atomów zmniejszają się podczas przesuwania się od lewej do prawej wzdłuż okresów.
- W miarę przemieszczania się od góry do dołu w grupie właściwości redukujące metalu rosną.
- Właściwości utleniające i niemetaliczne rosną w miarę przesuwania się okresu od lewej do prawej.
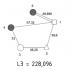
Czego dowiadujemy się o elemencie z tabeli? Weźmy na przykład trzeci pierwiastek w tabeli - lit i rozważmy go szczegółowo.

Przede wszystkim widzimy sam symbol elementu i jego nazwę pod nim. W lewym górnym rogu znajduje się liczba atomowa pierwiastka, w jakiej kolejności ułożone są pierwiastki w tabeli. Liczba atomowa, jak już wspomniano, jest równa liczbie protonów w jądrze. Liczba dodatnich protonów jest zwykle równa liczbie ujemnych elektronów w atomie (z wyjątkiem izotopów).
Masa atomowa jest podana pod liczbą atomową (w tej wersji tabeli). Jeśli zaokrąglimy masę atomową do najbliższej liczby całkowitej, otrzymamy tak zwaną liczbę masową. Różnica między liczbą masową a liczbą atomową daje liczbę neutronów w jądrze. Zatem liczba neutronów w jądrze helu wynosi dwa, a w litu cztery.
Nasz kurs „Układ okresowy dla opornych” dobiegł końca. Podsumowując, zapraszamy do obejrzenia filmu tematycznego i mamy nadzieję, że pytanie, jak korzystać z układu okresowego Mendelejewa, stało się dla Ciebie jaśniejsze. Przypominamy, że zawsze skuteczniej jest uczyć się nowego przedmiotu nie w pojedynkę, ale z pomocą doświadczonego mentora. Dlatego nigdy nie należy zapominać o obsłudze studenckiej, która chętnie podzieli się z Tobą swoją wiedzą i doświadczeniem.