Меднение стали гальваническое. Технология меднения в домашних условиях
Медь является одним из самых широко применяемых металлов в мире, еще издавна этот материал применяли для изготовления орудий труда. Такое активное использование меди обусловлено ее уникальными техническими и эксплуатационными свойствами. В настоящее время без меди невозможно существование таких отраслей производства, как металлургия, автомобильная промышленность, электротехника и строительство. Этот материал необходим и в бытовых условиях, именно поэтому многих так интересует, как проводить меднение в домашних условиях.
Под меднением принято понимать гальваническое нанесение меди, при этом толщина слоя должна находиться в рамках от одного до трехсот микрометров. Меднение – это покрытие медью металлического изделия в качестве подготовки к хромированию, использованию никеля или серебра. Однако данная процедура может использоваться и как самостоятельная обработка поверхности.
В качестве подготовительного процесса меднение стали способствует выравниванию поверхности, ведь, как известно, медь прочно держится на стали, чего не скажешь о других материалах. Различные металлы достаточно хорошо осаждаются на омедненное покрытие (намного лучше, чем на чистую сталь).
К отличительным характеристикам медного покрытия специалисты относят высокое сцепление с иными металлами, пластичность и надежность. Однако при постоянном воздействии факторов окружающей среды медное покрытие быстро окисляется и покрывается радужными разводами, пятнами и налетом.
Меднение можно производить на поверхностях из стали, цинка и даже алюминия. Только что нанесенный слой меди имеет малиновый оттенок со слегка заметным металлическим блеском.

Где используется?
Выделяют несколько основных случаев применения меднения:
- Для декорирования. В последнее время увеличился спрос на старинные медные изделия. При помощи специальной обработки нанесенный слой меди придает поверхности «состаренный вид».
- Данный способ нанесения железа используется для производства копий отдельных медных деталей различных форм и размеров. Сначала создается основа из воска или пластика, которую в последствии покрывают электропроводящим раствором и медным слоем. Такая технология широко применяется при изготовлении сувенирной продукции, ювелирных изделий, а также барельефов и волноводов.
- В электротехнике. Низкая стоимость меднения выгодно выделяет этот метод – по сравнению с покрытиями из серебра или золота, медные изделия могут применяться в электротехнических отраслях (для производства электродов, контактов под напряжением и в качестве основы под пайку).

Технологию меднения также совмещают с различными типами гальванизации:
- Для создания многослойного декоративного покрытия со слабыми защитными характеристиками. В таком случае используется медь, хром и никель – трехслойный защитно-декоративный слой, который повышает степень сцепления с основным материалом поверхности.
- Для защиты определённого участка детали при цементации. При гальванизации свинцовых изделий медью необходимо предохранение покрытий стальных элементов от науглероживания. Меднению поддаются только те участки, которые в дальнейшем будут подвергаться механической обработке.
- При реставрационных работах. В процессе омеднения на восстанавливаемой детали образуется промежуточный слой, который в дальнейшем послужит основой для более прочного покрытия (хромирования, никелирования). Для гальванического способа характерно нанесение толстого слоя меди, до двухсот пятидесяти микрометров. Это связано с необходимостью ликвидации всех повреждений и дефектов поверхности.

На видео: гальваническое меднение в декоративных целях.
Особенности процесса в быту
Омеднение металлических предметов носит название – гальваностегия. Принцип заключается в погружении предмета в раствор электролита с осажденным медным купоросом. Мало кто знает, что гальванизацию можно проводить и в домашних условиях, для этого не требуется наличие специального оборудование. Данная операция способствует подготовке поверхности к последующим обработкам либо служит промежуточной стадией при нанесении никеля, хрома, латуни.
Изделия, обработанные таким способом, с добавлением в медь других металлов, весьма устойчивы к агрессивным факторам. Меднение не предполагает особых навыков и профессиональных знаний, однако есть несколько нюансов, которые необходимо учитывать.
В быту осуществляется именно химическая гальванизация небольших деталей, поскольку она не требует больших финансовых затрат и дополнительного оборудования.

На видео: принцип меднения металлических предметов.
Как проводится химическое меднение на дому?
Чтобы нанести медь в домашних условиях, вам в первую очередь необходимо приготовить рабочий раствор и создать два разноименных электрода, так как в процессе омеднения ионы меди, находящиеся в электролитическом растворе, будут притягиваться к отрицательному полюсу. Нанесение на металлическую поверхность меди в промышленных условиях и в промышленных масштабах чаще всего используется как завершающая операция в обработке изделия.
Однако если вы собираетесь проводить меднение металла собственными силами, то должны знать порядок работы. Далее мы рассмотрим, как покрыть деталь медью в домашних условиях химическим способом с погружением в раствор электролита. Этот процесс легко можно выполнить на дому, если знать все особенности применения меди. Алгоритм выполнения:
1. Для растворителя меди на металле можно взять обычный аккумуляторный электролит. Он продается в любом хозяйственном магазине, однако его можно изготовить и собственными силами. Необходимо соблюдать пропорцию 100:3 дистиллированной воды и серной кислоты с поправкой на необходимый объем электролита. Затем в смесь добавляется до 20 грамм сульфата меди (медный купорос).

Важно! К медному купоросу могут добавляться и другие специализированные составы, в зависимости от конченой цели.

2. Предварительно деталь необходимо очистить абразивными материалами, для удаления оксидного слоя. Далее поверхность покрываемой детали обезжиривается горячим раствором карбоната натрия и промывается проточной водой (чтобы на металлах не скапливались различные загрязнения).
3. Гальванизационная емкость заполняется электролитическим раствором до нужного объема, после чего в раствор помещаются две медные пластины (на покрытиях которых будут образовываться ионы меди) на проводниках, а между ними размещается деталь, предназначенная для омеднения.

4. Концы проводников и подвесы для детали подключаются к источнику тока, в качестве которого могут выступать гальванические элементы либо аккумуляторные батареи (плюс на пластины, минус на деталь). В цепь предварительно необходимо последовательно подключить амперметр и реостат.

5. Процесс гальванизации занимает от пятнадцати до двадцати минут, после чего нужно отключить электропитание и извлечь деталь из раствора. Этого времени достаточно чтобы деталь покрылась тонким слоем меди. Для получения более толстого покрытия необходимо увеличить продолжительность процесса. Металлическая поверхность становится более прочной, повышаются ее технические и эксплуатационные свойства.
Как сделать раствор для домашнего меднения (3 видео)
Детали покрытые медью (25 фото)






















В этом интересном видео-уроке рассмотрим, как можно сделать раствор, который будет выполнять функции электролита для омеднения любых предметов из металла, например, алюминия с помощью туалетного утенка.
Что нужно для процесса.
Для этого нам понадобится пластиковая бутылка с водой, медный провод без изоляции. Желательно, брать проволоку минимального сечения, чтобы площадь реакции была максимально большой. Если нет медной проволоки, подойдут монетки, в состав которых входит медь не желтого цвета. Вместо провода или монеток можно использовать абсолютно любую медную стружку, обрезки, отходы, в которые входит медь. Также нужно добавить небольшой кусочек олова.

В качестве предмета для омеднения в данном видеоуроке будет выступать стальная рукоятка ножа. Кроме туалетного утенка может подойти и другое чистящее средство, в состав которого входит соляная кислота, которая входит в реакцию с медью и растворяет ее.
Приготовим состав раствора для меднения.
Итак для начала сделаем следующее. Содержимое туалетного утенка необходимо влить в бутылочку с водой, чтобы получить раствор, в который будет погружена медь. Теперь в раствор кладем медный провод и кусочек олова. После этого этот раствор необходимо оставить, желательно, в теплом месте на как можно более долгий срок. Концентрация соляной кислоты, которая содержится в утерке, требует держать баночку для растворения меди в течение одного месяца. Вот и весь состав раствора.
Обработка заготовки для покрытия медью.
Желательно металлическую заготовку очистить от ржавчины и грязи кипячением в растворе щёлочи или, на худой конец, обычный шкуркой.
Когда очистка и шлифовка закончена, необходимо заготовку обезжирить, так как пальцы рук человека содержат жир.
Перед использованием раствора для омеднения, его нужно хорошо встряхнуть, чтобы соли меди смешались с жидкостью. Теперь можно поместить заготовку в меднящий раствор. Желательно во время омеднения емкость с электролитом иногда покачивать, и переворачивать заготовку, чтобы создать приток свежего раствора к ней.
Прошло уже полтора часа, можно посмотреть, как прошел процесс. Хорошо видно, что заготовка покрылась медью. Ее нужно обязательно промыть водой. Медь на ней держится очень хорошо. Очень красиво получилось, но лучше не покрывать рукоять ножа медью, так как она имеет свойство окисляться и пачкать, соответственно, руку. можно сделать и не только это.
Медные покрытия, как правило, не применяются в качестве самостоятельного покрытия ни для декоративных целей, ни для защиты стальных деталей от коррозии.
Это связано с тем, что медь в атмосферных условиях легко окисляется, покрываясь налетом окислов.
Однако благодаря хорошему сцеплению осажденной меди с различными металлами медное покрытие применяется в многослойных защитно-декоративных покрытиях в качестве промежуточного подслоя, а также для защиты стальных деталей от цементации.
В гальванопластике медные осадки применяются для изготовления металлических копий, барельефов, волноводов и матриц.
Электролиты меднения подразделяют на кислые и щелочные . Из кислых электролитов используют сернокислые и борфтористоводородные. Наибольшее применение нашли сернокислые электролиты, отличающиеся простотой состава, устойчивостью и высоким выходом по току (до 100%). Недостатком этих электролитов является невозможность непосредственного покрытия стальных и цинковых деталей вследствие контактного выделения меди, имеющей плохое сцепление с основным металлом.
Поэтому перед меднением стальных детален в кислых электролитах их предварительно меднят в цианистых электролитах или осаждают тонкий подслой никеля. К недостаткам сернокислых электролитов относятся также их незначительная рассеивающая способность и более грубая: структура осадков по сравнению с другими электролитами.
К щелочным электролитам меднения относятся цианистые, пирофосфатные и другие электролиты.
Цианистые медные электролиты обладают высокой рассеивающей способностью, мелкокристаллической структурой осадков, возможностью непосредственного меднения стольных деталей. К недостаткам относятся низкая плотность тока и неустойчивость состава вследствие карбонизации свободного цианида под действием двуокиси углерода воздуха. Кроме того, цианистые электролиты характеризуются пониженным выходом по току (не более 60-70%).
Кислые электролиты меднения
Медь сернокислая — 150-250 г/л
Никель хлористый — 50-70 г/л
Температура = 18-25°С
Плотность тока = 1-4 А/дм2
При перемешивании электролита сжатым воздухом можно довести катодную плотность тока до 6-8 А/дм2.
Для приготовления сернокислого электролита меднения растворяют медный купорос, фильтруют его в рабочую ванну и при непрерывном помешивании добавляют серную кислоту.
При нанесении медных покрытий из сернокислого электролита медные аноды растворяются в основном с образованием двухвалентных ионов, которые, разряжаясь на катоде, осаждаются в виде металлической меди.
Однако наряду с этими процессами происходят п другие, нарушающие нормальное течение электролиза. Возможно также анодное растворение с образованием одновалентных ионов, хотя и в меньшей степени.
В электролите, омывающем металлическую медь, идет также химический обратимый процесс: Cu + Cu2+ = 2Cu+.
Накопление в растворе ионов одновалентной меди в больших количествах приводит к сдвигу реакции влево, в результате чего выпадает металлическая губчатая медь.
В растворе, кроме того, происходит окисление сернокислой одновалентной меди за счет кислорода воздуха н серной кислоты, особенно при воздушном перемешивании: Cu2SO4 + ½O2 + H2SO4 = 2CuSO4 + H2O.
На катоде процесс заключается в разряде двухвалентных и одновалентных ионов меди, но в связи с тем, что концентрация ионов одновалентной меди приблизительно в 1000 раз меньше концентрации ионов двухвалентной меди, катодный процесс выглядит так: Cu2+ + 2е- = Cu. Выход по току составляет 100%.
Для получения плотного гладкого осадка в электролите необходимо присутствие серной кислоты.
Меднение гальваникой и гальванопластика в домашних условиях
Серная кислота выполняет ряд функций:
значительно повышает электропроводность электролита;
понижает активность ионов меди, что способствует образованию мелкозернистых осадков;
предотвращает гидролиз сернокислой закисной меди, который сопровождается образованием рыхлого осадка закиси меди.
Дефекты при эксплуатации сернокислого электролита меднения и способы их устранения
|
Причина дефекта |
Способ устранения |
|
|
Грубая крупнокристаллическая структура осадков |
Недостаток кислоты |
Добавить кислоту |
|
Высокая плотность тока |
Снизить плотность тока |
|
|
Шероховатые осадки |
Загрязнение электролита механическими примесями |
Отфильтровать электролит |
|
Черные и коричневые полосы на покрытии |
Присутствие в электролите примесей тяжелых металлов, мышьяка, сурьмы |
Проработать электролит, при большом содержании примесей электролит заменить |
|
Пористые, рыхлые осадки |
Наличие в электролите солей железа |
|
|
Светлые блестящие полосы на покрытии, осадки хрупкие |
Присутствие в электролите органических примесей |
Отфильтровать электролит, проработать его током |
Борфтористоводородный электролит обладает несколько более высокой рассеивающей способностью, чем сернокислый.
Кроме того, в борфтористоводородных электролитах можно применять высокие плотности тока. Состав электролита (г/л) и режим меднения:
Медь борфтористоводородная – 35-40 г/л
Кислота борная – 15-20 г/л
Кислота борфтористоводородная – 15-20 г/л
Никель хлористый – 50-70 г/л
Температура = 18-25°С
Плотность тока = до 10 А/дм2
Электролит перемешивают сжатым воздухом или механической мешалкой.
Для приготовления борфтористоводородного электролита в борфтористоводородную кислоту небольшими порциями вводят свежеосажденную углекислую медь.
Раствор углекислой меди готовят подливанием подогретого концентрированного раствора соды к раствору сернокислой меди при перемешивании. Полученный осадок декантируют, промывают и растворяют в борфтористоводородной кислоте. В приготовленный раствор добавляют свободную борфтористоводородную и борную кислоту до требуемого значения рН (1-1,5). В ванну с полученным электролитом доливают воду до рабочего уровня.
(Деканта́ция, деканти́рование - в химической лабораторной практике и химической технологии механическое отделение твёрдой фазы дисперсной системы (суспензии) от жидкой путём сливания раствора с осадка.)
Электрохимический процесс — электро-тип, то есть. осаждение более толстого массивного слоя металла на поверхность объекта, форма которого должна быть распространена, скопирована, достаточно распределена. Например, гальванопластика используется в тех случаях, когда металлическая деталь имеет очень сложную форму и ее трудно или невозможно изготовить обычными способами (литье или механическая обработка).
Таким образом, скульптуры иногда воспроизводятся по образцам (автомобиль «Аполлон» на пьедестале Большого театра выполнен гальванопластикой).
Этот процесс относительно прост и может быть легко воспроизведен в домашних условиях.
Печать копируется из статьи или статьи для копирования, то есть из легкого металла, воска, пластика или гипса. Субъект, который нужно скопировать, вымыть с мылом, добавляется к картонной коробке и выливается низкоплавким сплавом из древесины или других сплавов.
После литья объект удаляют и полученную форму обезжиривают и ударяют путем литья в электролитической ванне.
Чтобы не откладывать металл по бокам формы, где нет никакого впечатления, они покрываются щеткой с расплавленным воском или парафином. После литья меди низкоплавкий металл растворяется в кипящей воде и получается матрица. Матрица заливается штукатуркой или свинцом, и копия готова. Следующая композиция для воска используется для изготовления пресс-форм:
Воск …………… 20 веков.
Гальванический. Бейкер, покрывающий алюминий.
час
Парафин ……… 3 v. час
Графит ……….. 1 v. час
Если форма изготовлена из диэлектрика (воск, пластик, парафин, гипс), его поверхность
покрытый электропроводящим слоем.
Передаточный слой может быть осажден с извлечением определенных металлов (серебра, меди, никеля) или механическими средствами — путем протирания поверхности графитом в виде листьев из щетки мягких волос.
Графит тщательно измельчают в фарфоровом растворе, просеивают через сито или марлю и наносят на поверхность продукта мягкой кистью или ватой. Графит лучше держит глину. Формы гипса, дерева, стекла, пластика и папье-маше покрыты раствором воска в бензине. На поверхности, которая не успевает высохнуть, поместите графит в порошок и излишек, без контроля графита.
Гальваническое покрытие просто отделено от графитовой формы. Если форма выполнена из металла, необходимо создать проводящую фольгу из оксида, сульфида или другой нерастворимой соли, такую как серебро — серебросодержащий хлорид свинца — сульфид свинца, чтобы обеспечить хорошее отделение от покрытия.
Медь, серебро и свинцовые поверхности обрабатываются 1% раствором сульфида натрия, что приводит к образованию нерастворимых сульфидов.
Отложение металла на поверхности пресс-формы. Готовая форма погружается в гальваническую ванну, схема которой находится под напряжением, так что снимаемая пленка не растворяется. Во-первых, «уплотнение» (покрытие) проводящего слоя меди осуществляется при низкой плотности тока в растворе этого
состав:
Серокислотная медь (сульфат меди) … 150-200 г.
Серная кислота 7-15 г
Этиловый спирт 30-50 мл
Вода …………………………………………. 1000 мл
Рабочая температура электролита составляет 18-25 ° С, плотность тока составляет 1 — 2 А / дм2.
Алкоголь необходим для
увеличить смачиваемость поверхности. Когда вся поверхность «подталкивается» медным слоем, форма переносится на электролит, предназначенный для гальванопластики. При гальванизации (медь) рекомендуется следующая композиция:
Серийно кислотная медь (сульфат меди) …..
340 c. час
Серная кислота 2 v. час
Вода …………………………………………. .1000 v. час
Температура электролита составляет 25-28 ° С. Плотность тока составляет 5-8 А / дм2.
Используя метод электроформовки, вы можете взять металлическое кружево для декоративно-художественного декоративно-художественного оформления различных предметов. Кружево растягивается на раме и пропитано парафином.
Затем вы протираете их между бумажными листами, чтобы удалить лишний парафин. Затем наносят электропроводящий слой тонкого графита, а избыток тщательно подталкивают кружевом. Путь провода — край кружева, он прикреплен к пластиковой раме или раме толстой проволоки с изолированным винилхлоридом вместе с кружевом, погруженным в электролит.
Лак, покрытый медью, обрабатывается латунной щеткой. Припаяйте их свинцовым припоем.
Гальваноспециальная обработка металлических кружев — использование декоративного слоя из серебра или золота или окисления.
<<<Вернуться назад
Технологии -> пекарь
пекарь
Покрытие баком
Медные покрытия обычно не используются как самостоятельное покрытие для декоративных целей, а также для защиты стальных деталей от коррозии. Это связано с тем, что медь в атмосферных условиях легко окисляется, покрывается окислением.
Однако из-за хорошей адгезии осажденной меди к различным металлам медное покрытие используется в многослойных защитных и декоративных покрытиях в качестве промежуточных подошв, а также для защиты стальных деталей от газификации.
Для электроформования медные нанотрубки используются для изготовления металлических копий, рельефов основания, волноводов и матриц.
Медные электролиты делятся на кислотные и щелочные.
Кислотные электролиты используются сульфатными и борфтористоводородными. Наибольшее применение было доступно для сульфатных электролитов, характеризующихся их простым составом, стабильностью и высокой силой тока (до 100%).
Недостатком этих электролитов является невозможность непосредственного применения стальных и цинковых деталей для отделения медных контактов, которые плохо склеиваются с основным металлом.
Поэтому перед нанесением меди на стальные детали в кислотных электролитах они предварительно сохраняются в цианидных электролитах или наносимых тонких никелевых пластин. Недостатки сульфатных электролитов также являются их незначительной рассеивающей способностью и более грубыми: структура осаждения по сравнению с другими электролитами.
Электролиты щелочной меди покрывают цианидом, пирофосфатом и другими электролитами.
Цианид-медные электролиты обладают высокой дисперсионной способностью, мелкокристаллической структурой осаждения, возможностью непосредственных медных табличных объектов. К недостаткам относятся низкая плотность тока и нестабильность состава за счет карбонизации свободного цианида под воздействием углекислого газа в воздухе.
Быстрое накопление меди.
Кроме того, цианидные электролиты характеризуются сниженной мощностью тока (не более 60-70%).
Будьте осторожны! Компания «LV-Engineering» не предоставляет услуги по гальванизации! Наша организация осуществляет проектирование гальванических изделий, производство гальванических ванных комнат и полипропиленовых линий, монтажные и пуско-наладочные работы в данном направлении.
Кислотные электролиты
Сульфат меди — 150-250 г / л
Никель-хлорид — 50-70 г / л
Температура = 18-25 ° C
Плотность тока составляет 1-4 А / дм2
Когда электролит смешивается со сжатым воздухом, плотность катодного потока может быть подключена к 6-8 А / дм2.
Для приготовления медносульфатного электролита растворите сульфат меди, процедите в рабочую пантеру и добавьте серную кислоту при непрерывном перемешивании.
Когда медные покрытия наносят из сульфатного электролита, аноды меди сначала растворяются с образованием двухвалентных ионов, которые осаждаются в виде металлической меди при выгрузке на катод.
Однако наряду с этими процессами существуют и другие, которые препятствуют нормальному течению электролиза. Анодное растворение возможно также при образовании одновалентных ионов, хотя и в меньшей степени.
В электролите, который удаляет медный металл, существует также химически обратимый процесс: Cu + Cu2 + = 2Cu +.
Накопление ионов иона иона в растворе в больших количествах приводит к тому, что реакция перемещается влево, а это означает, что к нему принадлежит медная медь.
Раствор также окисляет сульфаты меди из-за атмосферной серной кислоты N, особенно воздуха во время смешивания: Cu2SO4 + 1 / 2O2 + H2SO4 = 2CuSO4 + H2O.
На катоде в процессе отходящий двухвалентных и одновалентных ионов меди, но из-за того, что концентрация ионов одновалентной меди около 1000 раз ниже, чем концентрация ионов двухвалентной меди, катодная методом электроосаждения выглядит следующим образом: Cu 2+ + 2e = Cu. Токовый выход составляет 100%.
Присутствие сорбиновой кислоты требуется для получения плотного гладкого осадка в электролите.
Серная кислота выполняет множество функций: она значительно увеличивает электропроводность электролита; он уменьшает активность ионов меди, что способствует образованию мелких зерен; предотвращает гидролиз сульфата железа, что сопровождается образованием свободного осадка из оксида меди.
Ошибки электролита медно-сульфатного электролита и методы их устранения
| ошибка | Причина ошибки | средство |
| Грубая структура грубых осадков | Кислотный дефицит | Добавить кислоты |
| Высокая плотность тока | Уменьшить плотность тока | |
| Грубые сквозняки | Загрязнение электролита механическими примесями | Фильтровать электролит |
| Черные и коричневые линии на обложке | Наличие в электролитных примесях тяжелых металлов, мышьяка, сурьмы | Проверьте электролит с высоким содержанием примесей, замените электролит |
| Пористые, рыхлые отложения | Присутствие солей железа в электролите | |
| На крышке есть яркие блестящие линии, которые являются хрупкими | Присутствие органических примесей в электролите | Фильтруйте электролит и заряжайте его электричеством |
Борфторогидроэфир имеет немного большую мощность распыления, чем серная кислота.
Кроме того, флюсы высокой плотности могут использоваться в борфтористоводных электролитах. Состав электролита (г / л) и способ применения меди:
Гидрохлорид борфторида меди — 35-40 г / л
Борная кислота — 15-20 г / л
Соляная кислота — 15-20 г / л
Никель-хлорид — 50-70 г / л
Температура = 18-25 ° C
Плотность тока = до 10 А / дм2
Электролит смешивают со сжатым воздухом или механической мешалкой.
Свежую измельченную углеродную медь вводили небольшими порциями для приготовления скважинного углеводородного электролита в борфтористовородной кислоте.
Раствор углеродной меди готовят путем нагревания нагретого концентрированного раствора сульфата натрия в раствор сульфата меди путем смешивания. Полученный осадок декантируют, промывают и растворяют в борфтористой кислоте. К желаемому раствору добавляют свободную бороновую кислоту и борную кислоту до желаемого значения рН (1-1,5). Добавить воду на рабочую поверхность в ванне с электролитом.
 Если перед вами стоит задача омеднения каких-либо деталей в автомобиле, то оказывается это вполне возможно сделать в домашних условиях. Для этого не потребуется особых знаний и умений, да и все материалы и реагенты вполне можно найти в магазинах или своих запасах. Что же, давайте посмотрим как можно сделать омеднение.
Если перед вами стоит задача омеднения каких-либо деталей в автомобиле, то оказывается это вполне возможно сделать в домашних условиях. Для этого не потребуется особых знаний и умений, да и все материалы и реагенты вполне можно найти в магазинах или своих запасах. Что же, давайте посмотрим как можно сделать омеднение.
Когда делают омеднение и можно ли его использовать для коррозионного покрытия
Прежде чем рассказать о самом процессе, хотелось бы сказать пару слов о прагматичности такой операции.
Многие из автолюбителей не особо знакомых с химией сейчас скажут о необходимости омеднения всего чего попадется под руку, но мы вас предостерегаем от этого! Почему!? Да потому что все металлы между собой образуют гальваническую пару. Такая гальваническая пара образуется даже при попадании воды, а если средой будет еще и кислота, то процесс пойдет в разы быстрее.
Суть процесса в гальванической паре сводится к следующему. Более активный металл отдает свои электроны, а менее активный принимает. Вот так и образуется самая простая «батарейка» в которой протекает электрический ток.
Давайте теперь взглянем на стандартные электродные потенциалы:
— для меди Е0(Сu2+/Cu)=0,34В;
— для железа E0(Fe2+/Fe)=-0,44В.
В итоге получается не все так гладко.
Ведь в такой гальванической паре У железа электродный потенциал более активным. Опять же у меди электродный потенциал более положителен, чем у железа, поэтому она будет менее активна.
В итоге электроны потекут от железа к меди, что приведет к коррозии железа.


Все это мы рассказали к тому, что бездумно покрывать медью все что вам попадется под руку на машине не рекомендуется. Ведь в этом случае вы можете значительно сократить жизненный цикл многих железных деталей (крепеж, кузовные детали).
Гальваническое меднение
Не зря для сохранения железа применяют цинк, там ситуация с электродными потенциалами обратная.
Однако омеднение может применяться для декоративной отделки железа, если покрытие будет находиться в сухости.
Также медь может применяться в случаях, где необходимо обеспечить передачу электрического тока между контактами. Опять же надо следить за их чистотой.
Медь может применяться в условиях применения пар с незначительным трением скольжения. Все это в целом вполне жизнеспособные варианты. А значит и омеднение все же имеет шанс на его реализацию.
Тогда не будем более медлить, расскажем непосредственно о процессе омеднения.
Процесс омеднение деталей в домашних условиях (расчет слоя покрытия при определенном токе)
Омеднение происходит в растворе. По сути этот процесс обратный гальванической паре, то есть тому, о чем мы рассказывали в абзаце выше.
Для раствора нам понадобиться кислота, можно взять электролит используемых для аккумуляторов. Воду и медный купорос.

Для раствора берется 100 мл электролита на 20 мл воды и добавляется 20 г медного купороса.
В качестве донора меди можно взять медные пластинки или обычный медный провод, предварительно очищенный от изоляции. Итак, именно в этот самый раствор и помещаем медь. При этом подключаем блок питания постоянного напряжения питания к меди (+) и к железу (-). Ток на блоке питания выставляем тот, при котором мы планируем за определенный период времени нанести определенный слой меди. Это уже задача по химии школьной программы.
И получается все так…
I= (плотность меди (8920 кг/м3)*площадь детали (скажем 0,1 м3)*(требуемый слой (скажем 0,0001 м, то есть 0,1 мм))/ (электрохимический эквивалент для меди это 6,6*〖10〗^(-7)
* желаемое время, скажем 3 часа – 10800 секунд). Считаем…
I=8920*0,1*0,0001/0,0000066*10800=0,0892/0,07128=1,25 А
То есть за 3 часа при токе 1,25 А у нас будет покрытие в 0,1 мм на детали площадью 0,1 м3. Вот как-то так и считаем все аналогичные вариации.

А да, время от времени не забываем помешивать раствор, чтобы процесс шел равномерно.

После того как омеднение завершено, вытаскиваем детали из раствора и отмываем хорошо с щелочью, то есть с мылом.

Если есть каике-то заусенцы и отклонения от формы, то их вполне можно пройтись наждачной бумагой и заполировать.
Собственно вы теперь не меньше знаете, как производить омеднение поверхности.
Надо сказать, что по тому же принципу производится и оцинкование и хромирование… В итоге понимая принцип происходящего процесса можно перенести процесс покрытия поверхности и на другие металлы.
Состояние электрического тока растворов цианистого меди значительно отличается от тех, которые считаются наиболее благоприятными в кислотных растворах. Из-за того, что образуются сильные сложные ионы и очень низкая скорость диссоциации, активность ионов меди в цианидном растворе настолько мала, что потенциал около 1 В становится более отрицательным, чем раствор серной кислоты.
Увеличивая плотность тока, катодный потенциал меди в цианидных электролитах, в отличие от кислоты, сильно изменяется в направлении электроотрицательных значений (рис.
84), который определяет условия кристаллизации и распределения металла на поверхности катода; С этой точки зрения условия в цианидных электролитах чрезвычайно благоприятны.
Но именно из-за потенциала катода быстро растет с плотностью тока, это не может быть существенно увеличено, в противном случае выходной ток металла может быть сведен к нулю.

Рис. 84. Кривые поляризации медных электролитов:
1-сульфатного электролита 1,5-n. CuSO4 + 1,5-n.
H2S04; 2-цианидный электролит композиции 0,25-n.
CuCN + 0,6-n. NaCN + 0,25-n. Na2C03; 3 — тот же электролит при 45 ° C; 4 представляет собой тот же электролит в присутствии Na2S2O3
Еще одно важное различие в кислотности цианидных электролитов следует рассматривать как значительные изменения в характеристиках меди в зависимости от концентрации свободного цианида, в то время как свободная серная кислота оказывает очень мало влияния на характеристики меди в кислотных электролитах.
Если в растворе, содержащем 9 г меди на литр в форме цианидной соли (0,1 м.
Гальванизация собственными руками дома: технологии и оборудование
CuCN) и 13 г / л KCN, медный потенциал -0,60 В, в присутствии 26 г / л KCN этот потенциал равен -0,964 В и в присутствии 65 г / л -1,169 В.
Катодная поляризация также сильно зависит от концентрации солей меди в электролите, в то время как кислотные электролиты оказывают незначительное влияние.
Анодный процесс в цианидных электролитах также сопровождается значительной поляризацией, размер которой в основном определяется содержанием свободного цианида.
Отсутствие цианидного анода неактивно до полного растворения их растворения. Таким образом, содержание свободного цианида оказывает диаметрально противоположное воздействие на процессы катодного и анодного; Сначала требуется минимальное содержание свободного цианида (катодная плотность тока может быть выше, чем ниже цианид в электролите), второй — по величине (анод пассивации начать с самой высокой плотностью тока, тем выше содержание цианида).
Это значительно ограничивает выбор концентрации цианида, который является основным компонентом электролита из соли меди.
Для большинства цианидов электролиты не могут полностью использовать методы, которые позволяют им использовать увеличенную плотность тока, такую как смешивание или значительное повышение температуры, по той причине, что эти процессы ускорили гидролиз цианида. Даже в состоянии покоя при комнатной температуре цианид электролита разрушается быстрее, чем кислота, что приводит к абсорбции углекислого газа из воздуха.
Электролиты из цианид-меди, нанесенные на катод, извлечение из одновалентных ионов, т. Е. При 1 Ач теоретически получают в два раза больше меди, чем в кислотных электролитах, где медь присутствует в виде двухвалентных ионов.
Тот факт, что цианистые электролитный баланс потенциал медь сильно отрицательная с более высоким потенциалом плотности тока переместился от электрических величин служат в качестве основы для суждения невозможности осаждения меди из цианистых электролитов при высоких плотностях тока (по заказу 10 А / дм 2) с теоретическим или вблизи теоретического выхода поток.
На самом деле это справедливо только для разбавленных цианидных электролитов, не страдают от перемешивания и нагрева. При определенных условиях медь может выделяться на электролитах с цианидным катодом, особенно при низком содержании свободного цианида в электролите при высоких температурах и при смешивании при достаточно высокой плотности тока и эффективности тока, близкой к теоретической.
Кому-то может будет интересно, как провести процесс омеднения в домашних условиях. Этому обучает нас видео из Ютуба, загруженное ютубером TOKARKA.
Кому может пригодится этот урок? Я думаю многие умельцы из Самоделкина захотят украсить свои предметы путем омеднения. Вот несколько способов применения на фото.



Теперь, когда вы загорелись желанием быстрее узнать как это делается, посмотрите видео и потом пошагово изучим технологию.
В первую очередь определимся, что необходимо для проведения процесса омеднения:
1) Туалетный утенок или другое чистящее средство в составе которого имеется соляная кислота.
2) Медные провода, самого мелкого сечения,кусочки меди, монеты,содержащие медь.
3) олово
4) пластиковая бутылка с водой
5) железный предмет для омеднения

В пластиковую бутылочку с водой заливается жидкость из "Туалетного утенка". Делается раствор.

В бутылочку помещается медный провод.

Закупоривается бутылочка и взбалтывается.

После этого тара ставится в теплое место примерно на месяц, чтобы произошли химические реакции. Скорость реакции зависит от концентрации раствора, количества меди и тепла.

Пока раствор готовится,надо подготовить предмет металлический для омеднения.
Металлическая поверхность очищается от пыли, грязи, ржавчины, масляных пятен, которые остаются от прикосновения пальцами.
Это достигается кипячением в растворе щелочи или в растворе пищевой соды, которая имеется в любой кухне.

Перед омеднением необходимо зашкурить поверхность наждачной бумагой N100, чтобы поверхность была шероховатой. Чем больше шероховатости, тем лучше пройдет процесс омеднения.

После зачистки шлифшкуркой идет обезжиривание, средство против обезжиривания тоже есть на кухне.

Заготовка берется заранее приготовленной салфеткой.

В пластмассовую посуду, которая выбирается по размеру заготовки, заливается раствор,предварительно размешанная в бутылке.

Хирургическим зажимом, пинцетом или даже щипчиками для ощипывания бровей заготовка опускается в раствор.


Во время омеднения емкость лучше покачивать для лучшего и быстрого прохождения реакции.

Переворачивать заготовку время от времени.

Примерно через полтора часа или больше можно уже увидеть воочию, что происходит с погруженным в раствор предметом.

На поверхности обычной стали омеднение держится очень хорошо.

Теперь говорим "спасибо" нашему мастеру TOKARKA за урок. Что дает омеднение в двух словах. Улучшается электропроводность металлических предметов, болты не пригорают к поверхности, особенно где имеются большие температуры (коллектор, глушитель и тд.) Можно применить омеднение одноразовых болтов, особенно на иномарках, когда необходимо собрать узел, а необходимых болтов нет негде. В декоративных целях.Остальное зависит от вашей фантазии. Пользуйтесь.
Когда речь идет о гальванотехнике, сразу же на ум приходят такие технологические операции, как хромирование и цинкование металлоизделий. Но если задать вопрос, а что представляет собой гальваностегия, то ответит не каждый – проверено. Хотя ничего сверхнового данный термин не подразумевает.
Проще говоря, это методика покрытия тончайшим слоем металла любого материала, будь-то сталь, алюминий, древесина или пластик. С тем, как произвести меднение какого-либо образца в домашних условиях, мы и разберемся.
Общая информация
Меднение – методика отчасти более универсальная, чем то же цинкование. Для каких целей оно проводится?
- Защита образцов от цементации перед их раскроем способом резания, а также от коррозии.
- Устранение дефектов на поверхностях деталей, когда иные способы неприемлемы или трудны в реализации. К примеру, если основа характеризуется сложным рельефом.
- Декорирование изделий.
- Создание копий образцов из других материалов.
- Подготовка деталей из стали к , серебрению, золочению. В подобных случаях меднение является лишь одним из этапов работы по поверхностной обработке материала.
- Для создания сегментов «под пайку».
Вряд ли читателя заинтересуют такие нюансы, как классификация меди (рафинированная, бескислородная, общего применения), различные варианты растворов, использующихся при меднении, характеристики материалов и подобные вещи. Далее рассмотрены лишь простейшие методы нанесения Cu на любую поверхность, которые несложно организовать в домашних условиях, без каких-либо сложностей и финансовых затрат.
Меднение в электролите
Такая методика подходит лишь для покрытия слоем Cu металлических деталей. По сути, технология мало чем отличается от того же цинкования в домашних условиях.
Подготовка
Оборудование понадобится простейшее:
Ванночка (емкость) стеклянная. Ее вместительность определяется габаритами обрабатываемой детали. Даже литровая банка или стакан – как варианты.

Медные электроды. Как правило, используются два. Это позволяет более качественно покрыть заготовку слоем со всех сторон и упрощает сам процесс. По ходу работы не придется периодически менять положение детали относительно электрода. Что именно использовать, зависит от конкретной ситуации – пластины из меди, куски толстой проволоки. Это непринципиально.
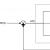
Источник тока и соединительные провода. Достаточно даже маломощного блока питания, на 6 – 8 В. Если в БП нет встроенного амперметра и не предусмотрена плавная регулировка напряжения, то придется использовать соответствующий прибор и реостат как отдельные элементы электрической цепи. Примерная схема, которую собирают для меднения деталей, показана на рисунке.

Электролит. Можно использовать покупной раствор, хотя придется и поискать. Если же его готовить самому, то на 100 мл воды дистиллированной понадобится серная кислота (3 мл) и медный купорос (20 г) – не дефицит.
Процесс меднения
- Деталь зачищается от наслоений. При необходимости – протравливается, погружается в специальные растворы для удаления инородных фракций. Что именно использовать, зависит от степени и вида загрязнения.
- Обезжиривание образца. Самый простой способ – окунуть в раствор соды (горячий), а потом промыть водой для удаления ее остатков.
- В емкость наливается приготовленный состав и помещаются электроды. Уровень раствора выбирается так, чтобы он полностью покрывал обрабатываемую деталь.
- Погружение изделия. Оно подвязывается на проводе, который соединяется с «–» БП. Необходимо проследить, чтобы заготовка не касалась стенок ванночки, ее дна и электродов.
После включения напряжения величина тока постепенно повышается до расчетного значения, и в таком режиме обработка осуществляется в течение ⅓ часа (время ориентировочное). Если меднение проводится впервые, то следует контролировать данный процесс. О том, что деталь можно вынимать из емкости, судят по оттенку ее поверхности и равномерности покрытия (отсутствию необработанных участков, раковин, вкраплений и так далее).
Остается лишь смыть с образца остатки электролита и просушить. Получается, что эта технология для реализации в домашних условиях никакой сложности не представляет.
Меднение без ванночки
Данным способом можно наносить металлическое покрытие на любые материалы. Суть заключается в «обмазке» (без прямого контакта) заготовки электролитом специальной кисточкой, щетинки которой – медные проволочки. Недостаток этой технологии в том, что добиться качественного меднения рельефных поверхностей вряд ли удастся. По крайней мере, понадобится много времени и усилий, чтобы тщательно обработать все «щели» и «выбоины».
Особенности подготовительного этапа
Кисточка. В домашних условиях ее делают из многожильного медного проводника. Снять изоляцию и «распушить» один его конец – не проблема. Чтобы было удобнее работать, стоит подумать, из чего изготовить рукоятку кисточки. Ею придется водить по поверхности образца, а с учетом того, что провода гибкие, такое меднение станет испытанием для мастера. Как вариант – подвязать «рабочую часть» к карандашу, пластиковому корпусу шариковой ручки. Догадаться несложно.
Тара. Деталь перед меднением укладывается на любую подходящую посуду. Для удобства работы она не должна иметь высоких бортиков. Оптимальный вариант – тарелка. Плюс к этому – емкость, в которой будет электролит. В нее придется постоянно опускать кисточку, поэтому и здесь выбор не затруднен. Подойдет и стакан, если образец небольшой и раствора понадобится немного. Соответственно, вся тара предварительно обрабатывается – моется, чистится, кипятится, обезжиривается.
Сборка схемы. Аналогично предыдущему способу. Кисточка выполняет функцию анода, поэтому ее к «+» БП, а покрываемая деталь является катодом (к «–»).
Процесс меднения
Для обеспечения неразрывности электрической цепи в посуду наливается электролит, так, чтобы его уровень превышал высоту детали. Кисточкой, которая периодически также обмакивается в растворе (для этого он и заливается в отдельную тару), необходимо водить по-над образцом. В результате его поверхность покрывается слоем меди. По сути, производится ее напыление.

Понятно, что такой процесс в исполнении более сложный, так как проводится в «ручном» режиме. Необходимо постоянно следить, чтобы между кистью и обрабатываемой основой был небольшой зазор. Но и это не главное. Его неизменность – одно из условий равномерности покрытия.
В каких случаях целесообразно использовать такой способ меднения
- Если материал образца не является токопроводящим.
- При больших габаритах детали. Подобрать в домашних условиях ванночку соответствующих размеров, к примеру, для люстры, вряд ли получится.
Как определить требуемые параметры блока питания? Для плотности тока при меднении нормой считаются 0,5 А/дм² образца, который предстоит покрыть защитным слоем.
- Превышение расчетного значения чревато тем, что медь сильно потемнеет, к тому же не будет прочно держаться на основе.
- При сложной конфигурации детали, наличии множества выступов, заостренных сегментов плотность тока берется меньшей, примерно в 2,5 раза.
Медь довольно быстро окисляется. Перед началом процесса обработки изделия электроды следует хорошо зачистить.
Время выдержки детали в растворе выбирается исходя из того, какой толщины слой необходимо получить при меднении. Зависимость прямая – чем дольше идет обработка, тем толще покрытие.
При необходимости восстановления внешнего вида истершихся элементов фурнитуры (мебельной или иной) их меднение – неплохой выход из положения.
Автор не единожды сталкивался с тем, что люди, озабоченные проблемами экологии, сразу же задаются вопросом – а как в домашних условиях организовать утилизацию отработки? Ведь электролит не вечен, и использовать его всю жизнь точно не получится. Кстати, вполне резонное и более чем справедливое замечание.
Есть неплохое решение – собирать оставшуюся после меднения «бурду» в отдельной стеклянной емкости. Зачем? Пригодится. Этот раствор отлично подходит для обработки древесины. Ваш покорный слуга, читатель, сам пропитывал им лаги перед настилом полов на даче. Учитывая, что зимой она не отапливается, условия эксплуатации материала понятны. Когда спустя 12 лет потребовалось переложить половицы, выяснилось, что лаги – как новенькие. Не было даже малейшего намека на какую-то плесень, следы гнили.
Так как любому из нас приходится заниматься если не строительством, то уж ремонтом обязательно, нет смысла куда-то потихонечку, подальше от сторонних глаз, сливать использованный электролит. Не по-хозяйски это.