Способ получения карбоната кальция с подвергнутой реакционной обработке поверхностью и его применение. Отчет по практике: Приготовление суспензий и эмульсий, порошков и растворов, настоев и отваров
Приготовление дисперсных систем.
Цель:
- получить дисперсные системы и исследовать их свойства
- практически познакомиться со свойствами различных видов дисперсных систем;
- провести эксперимент, соблюдая правила техники безопасности.
Оборудование и реактивы:
- дистиллированная вода;
- вещества и растворы: карбонат кальция, масло, раствор глицерина, мука, желатин
- фарфоровая чашка;
- пробирки, штатив.
Теоретическая часть
Чистые вещества в природе встречаются очень редко, чаще всего встречаются смеси. Смеси разных веществ в различных агрегатных состояниях могут образовывать гомогенные(растворы) и гетерогенные(дисперсные) системы.
Дисперсными-
называют гетерогенные системы, в которых одно вещество - дисперсная фаза (их может быть несколько) в виде очень мелких частиц равномерно распределено в объеме другого -дисперсионной среде.
Среда и фазы находятся в разных агрегатных состояниях – твердом, жидком и газообразном. По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся 2 группы:
- Грубодисперсные (взвеси) с размерами частиц более 100 нм. Это непрозрачные системы, в которых фаза и среда легко разделяются отстаиванием или фильтрованием. Это- эмульсии, суспензии, аэрозоли.
- Тонкодисперсные- с размерами частиц от 100 до 1 нм. Фаза и среда в таких системах отстаиванием разделяются с трудом. Это: золи (коллоидные растворы- "клееподобные") и гели (студни).
| Коллоидные системы прозрачны и внешне похожи на истинные растворы, но отличаются от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. При определенных условиях в коллоидном растворе может начаться процесс коагуляции. | ^ |
Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок. При этом коллоидный раствор превращается в суспензию или гель. Гели или студни
представляют собой студенистые осадки, образующиеся при коагуляции золей. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление синерезиса Различают 8 типов дисперсных систем.(д/с + д/ф)
|
Ход работы
| Опыт | Результат | |
| Опыт №1 Приготовление суспензии карбоната кальция в воде. | В стеклянную пробирку влить 4-5мл воды и всыпать 1-2 ложечки карбоната кальция. Пробирку закрыть резиновой пробкой и встряхнуть несколько раз. | Наблюдения: *Внешний вид и видимость частиц:_______________________ _____________________________ _____________________________ *Способность осаждаться и способность к коагуляции ___________________ ____________________________ ______________________________ |
| Опыт №2 Приготовление эмульсии масла в воде и изучение ее свойств | В стеклянную пробирку влить 4-5мл воды и 1-2 мл масла, закрыть резиновой пробкой и встряхнуть несколько раз. Изучить свойства эмульсии. Добавить 2-3 капли глицерина. | Наблюдения: *Внешний вид и видимость частиц: ______________________________ ______________________________ _____ *Способность осаждаться и способность к коагуляции __________________________ *Внешний вид после добавления глицерина _____________________ ____________________________ |
| Опыт №3 Приготовление коллоидного раствора и изучение его свойств | В стеклянный стакан с горячей водой внести 1-2 ложечки муки (или желатина), тщательно перемешать. Пропустить через раствор луч света фонарика на фоне темной бумаги | Наблюдения: *Внешний вид и видимость частиц __________________________ *Способность осаждаться и способность к коагуляции _____________________________ _____________________________ _____________________________ *Наблюдается ли эффект Тиндаля ______________________________ ______________________________ |
Общий вывод:____
Испытание растворов кислот индикаторами. Взаимодействие металлов с кислотами. Взаимодействие кислот с оксидами металлов.
Взаимодействие кислот с основаниями. Взаимодействие кислот с солями.
Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований.
Взаимодействие солей с металлами. Взаимодействие солей друг с другом. Гидролиз солей различного типа.
Цель работы:
· изучить свойства сложных неорганических веществ
Приборы и реактивы :
· пробирки, штативы.
· Растворы: HCl, NaOH, K 2 CO 3 , CH 3 COOH, CaO, Fe(OH) 3 , H 2 SO 4 , BaCl 2 , KOH, Ca(OH) 2 , Mg(OH) 2 , CuSO 4 , FeCl 3 , K 2 S, K 3 PO 4 , CaCl 2 , Na 3 PO 4 ,
· гранулы цинка,
· индикаторы.
Теоретическая часть
Гидролиз – это процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита. Все соли можно разделить на 4 группы:
- Соль образована сильным основанием и сильной кислотой К 2 SО 4 , Na NO 3 ,)– гидролиз не идет, среда нейтральная рН = 7 .
- Соль образована слабым основанием и слабой кислотой (MgСО 3 , Al 2 S 3 , Zn(NO 2) 2) - гидролиз протекает практически в нейтральной среде рН ближе к 7 , гидролиз идет по катиону и аниону:
- Соль образована сильным основанием и слабой кислотой (например: Na 2 СО 3 , К 2 S, Ва(NO 2) 2, СН 3 СОО Li) -гидролиз протекает в щелочной среде рН >7 , гидролиз идет по аниону.
- Соль образована слабым основанием и сильной кислотой (MgSО 4 , AlCL 3 , Zn(NO 3) 2, ..) - гидролиз протекает в кислой среде рН< 7 , гидролиз идет по катиону.
Глубина гидролиза зависит от температуры (чаще всего ее приходится повышать) и концентрации раствора (при разбавлении раствора гидролиз усиливается)
Если продукты гидролиза летучи,или нерастворимы, то он необратим.
Существует два метода приготовления суспензий: дисперсионный и конденсационный.
Техника приготовления суспензий дисперсионным методом предопределяется физико-химическими свойствами лекарственных веществ, входящих в ее состав, которые по отношению к воде разделяют на две группы: гидрофильные и гидрофобные (см.
Рис. 14.1).
Приготовление суспензий гидрофильных веществ не требует введения стабилизаторов, так как на поверхности частиц, имеющих сродство к дисперсионной среде, образуется гидратный (сольватный) слой, обеспечивающий устойчивость системы.
 |
Для получения тонкоизмельчен- ных лекарственных веществ рекомендуется при их растирании применять воду или другую вспомогательную жидкость, которая снижает твердость вещества и способствует процессу диспергирования, доводя размер частиц до 0,1-5 мкм. Это объясняется расклинивающим действием жидкостей, которые, проникая в микротрещины, образующиеся при дроблении вещества, создают расклинивающее действие Рр, которое действует противоположно стягивающему действию вогнутого мениска -
так называемому лапласовскому давлению Рл и значительно больше Рл. Микротрещины расширяются, и происходит дальнейшее измельчение вещества (эффект Ребиндера, рис. 14.2). Чем выше энергия смачивания, тем более выражен расклинивающий эффект, тем лучше диспергируется вещество. Академик Б.В.Дерягин установил, что максимальный эффект диспергирования в присутствии жидкости наблюдается при добавлении 0,4-0,6 мл жидкости на 1 г твердого вещества (40-60%). Гидрофильные лекарственные вещества легче диспергируются в присутствии воды, а гидрофобные - спирта.
Суспензии, в которых частички дисперсной фазы хорошо диспергированы и покрыты сольватными оболочками, состоящими из молекул дисперсионной среды, характеризуются большей агрегативной устойчивостью, ибо образовавшиеся оболочки на поверхности частиц препятствуют их агрегации.
Для получения более тонких и устойчивых водных суспензий гидрофильных набухающих веществ (висмута нитрата основного, цинка оксида, магния оксида, кальция фосфата, карбоната и глицерофосфата, коалина, натрия гидрокарбоната, железа глицерофосфата) наиболее целесообразно использовать прием взмучивания, который является разновидностью дисперсионного метода. Сущность приема заключается в том, что вещество диспергируют сначала в сухом виде, затем - с учетом правила Дерягина. Полученную тонкую пульпу разбавляют примерно в 10 раз водой (раствором), растирают и сливают верхний слой суспензии в склянку для отпуска. Операцию взмучивания повторяют до тех пор, пока все вещество не будет диспергировано и получено в виде тонкой взвеси.
Если диспергированное вещество способно набухать в растворителе, его растирают очень тщательно в сухом виде, так как добавление жидкости понижает и затрудняет диспергирование.
Суспензии могут быть стабилизированы электролитами, создающими в пограничном слое дзета-потенциал определенного знака и величины за счет адсорбции ионов из раствора и диссоциации или гидролиза поверхностного слоя твердой фазы. Однако электролиты, добавленные к суспензии, стабилизируют последние лишь при определенных концентрациях. При превышении концентрации электролита стабилизирующее действие переходит в коагулирующее.
Наиболее сильно проявляют стабилизирующее действие в суспензиях ВМС, которые образуют защитные гидратные слои на поверхности частиц дисперсной фазы или охватывают частицы длинными цепочечноподобными макромолекулами (рис. 14.3).
Устойчивость суспензий с гидрофильными веществами значительно повышается в присутствии вязких веществ (сахарный сироп, фруктовые сиропы). В этом случае вещества тщательно растираются
с небольшим количеством сиропа и полученную пульпу разбавляют оставшимся сиропом, а затем - водой.
Стабилизированные суспензии дозируются более точно.
Для получения устойчивых суспензий гидротротых веществ необходимо введение стабилизаторов, лиофилизирующих (увеличивающих сродство к воде) поверхность частиц и способствующих образованию сольватных оболочек.
В качестве стабилизаторов используют природные или синтетические ВМС: камеди (аравийскую и абрикосовую), белки, желатозу, слизи (алтея, льняного семени, салепа), природные полисахариды и комплексы, метилцеллюлозу, натрий-карбоксиметилцеллюлозу, по- ливинилпирролидон, полиглюкин, твины, спены и другие ПАВ, способные уменьшать поверхностную энергию в системе.
При использовании стабилизаторов целесообразно применять их растворы, с которыми растирают суспендируемое вещество. Не следует использовать излишне большие количества стабилизаторов, значительно увеличивающих вязкость суспензии. Соотношение между твердой фазой суспензии и ВМС зависит от степени гидрофобности и гидрофилизирующих свойств вещества. Количество стабилизатора, необходимое для стабилизации суспензии, определяется преимущественно эмпирически. В общем случае его коли честю не должно превышать количество суспендируемого вещества.
При приготовлении суспензий гидротротых веществ с нерезко выраженными свойствами - бензонафтол, терпингидрат, сульфаниламиды (сульфадимезин, сульфадиметоксин, сульфамонометоксин, салазопиридазин, фталазол, этазол и др.) - на 1 г вещества берут 0,25 г абрикосовой камеди или 0,5 г желатозы, или 1 г 5% раствора метилцеллюлозы, или 0,1 г твина-80. Суспензии сульфаниламидов и антибиотиков часто готовят с применением в качестве стабилизаторов метилцеллюлозы или твина-80.
Одновременно следует учитывать, что твины и спены нельзя использовать в суспензиях салицилатов, производных параоксибен- зойной кислоты, фенола и других веществ, с которыми они несовместимы, а также отрицательное действие концентрированных растворов электролитов на защитные свойства растворов камедей и желатозы.
Для приготовления суспензий гидрофобных веществ с резко выраженными свойствами (камфора, ментол и др.) количество гидрофи- лизирующих веществ увеличивается в 2 раза по отношению к их массе.
Особого подхода требует приготовление суспензии серы, где применение общепринятых стабилизаторов нецелесообразно ввиду уменьшения ее фармакологического действия. В качестве стабилизатора суспензии серы для наружного применения рекомендуется мыло медицинское в количестве 0,1-0,2 г на 1 г серы. Являясь ПАВ, мыло медицинское разрыхляет поры кожи, способствует проникновению серы, что целесообразно при лечении чесотки и других кожных заболеваний. Мыло медицинское в качестве стабилизатора необходимо применять только по согласованию с врачом. Для получения стабильной суспензии серы в сочетании с кислотами, солями щелочно-земельных и тяжелых металлов количество мыла следует увеличить до 0,3-0,4 г на 1 г серы, так как мыло с указанными веществами образует нерастворимые соли.
При приготовлении суспензии с серой в качестве стабилизатора можно использовать также натрий-карбоксицеллюлозу.
Конденсационный метод используют в аптечной практике с целью получения высокодисперсных (тонких) суспензий (мутных микстур) путем:
0 химического взаимодействия веществ, порознь растворимых, но реагирующих при сливании растворов с образованием взвеси. Например, при сливании растворов натрия гидрокарбоната и кальция хлорида образуется тонкая суспензия кальция карбоната;
0 разведения водой или водными растворами солей жидких экстрактов или настоек. В результате значительного понижения концентрации спирта выпадают вещества, нерастворимые в спиртоводных растворах (концентрация спирта менее 20%), с образованием мутных микстур.
Во избежание получения грубодисперсных систем необходимо настойки й экстракты добавлять к разбавленным водным растворам солей, т.е. в конце процесса приготовления микстуры в соответствии с требованиями ГФ.
В мутных микстурах осадки, как правило, образуются достаточно тонкими и хорошо распределяются в жидкой среде при взбалтывании. Но иногда выпавший осадок склонен к агрегации и оседанию или флокуляции, может прилипать к стенкам склянки для отпуска. В таких случаях рекомендуется использовать стабилизатор, который добавляют либо к водной микстуре, либо к настойке или жидкому экстракту, а затем жидкости смешивают.
Во всех случаях, когда в микстуру входят сиропы, слизи или вещества, содержащие слизь, которые могут стабилизировать гидрофобные компоненты суспензии, целесообразно их смешивать с настойками, жидкими экстрактами, нашатырно-анисовыми каплями и т.д., а затем добавлять к водным растворам солей.
Следует отметить, что используют лишь разрешенные к медицинскому применению загустители, ПАВ, корригенты и другие вспомогательные вещества.
Не допускается приготовление суспензий, содержащих ядовитые вещества (ГФ XI).
Все виды суспензий отпускают в склянках из бесцветного стекла (чтобы можно было видеть результаты взбалтывания) с предупредительной этикеткой “Перед употреблением взбалтывать”. Микстуры- суспензии хранят в прохладном, защищенном от света месте.
Cтраница 1
Суспензия карбоната кальция имеет рН, приблизительно равный1 7 4, но эта суспензия не так хороша для осаждения, как суспензия карбоната бария-вследствие гораздо большей величины взвешенных частиц.
Суспензия карбоната кальция имеет рН, приблизительно равный1 7 4, но эта суспензия не так хороша для осаждения, как суспензия карбоната бария, вследствие гораздо большей величины взвешенных частиц.
Через суспензию карбоната кальция в воде пропускают ток диоксида углерода; раствор становится прозрачным.
Образующийся продукт состоит из суспензии карбоната кальция в растворе едкого натра и избытка карбоната натрия или гидрата окиси кальция в зависимости от соотношения смешанных реагентов. Находящийся во взвешенном состоянии карбонат кальция образует центры кристаллизации, увеличивающие скорость осаждения. Заранее образованные частицы карбоната кальция находят применение в умягчительных установках с осветлителями. Частицы песка, как центры кристаллизации карбоната кальция, используют при умягчении воды в вихревом реакторе.
Влияние различных факторов на свойства суспензии карбоната кальция в первую очередь проявляется в соотношении коа-гуляционного и кристаллизационного процессов.
При отравлении кислотами следует принять внутрь суспензию карбоната кальция (мел) или оксида магния или выпить разбавленного раствора соды.
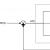
| Схема очистки сточной воды на нефтеперерабатывающем заводе Бритиш Америкен компани. |
В эту камеру по трубопроводу 2 подается суспензия карбоната кальция. Из первичной камеры смешения и реакций вода поступает во вторичную камеру смешения и реакций 6, в которую также подается суспензия карбоната кальция.
Соотношение между различными типами процессов образования осадка в суспензии карбоната кальция регулируется очень многими факторами, действующими в процессе рассоло-очистки. Этот процесс еще более усложняется при совместном выделении карбоната кальция и гидроокиси магния. Последняя, адсорбируясь на поверхности СаСО3, оказывает большое влияние на процессы коагуляции и кристаллизации в твердой фазе.
Фторид или хлорид бора выделяет двуокись углерода из суспензии карбоната кальция в смеси ацетона и четыреххлористого углерода.
Параметры этих зависимостей установлены в опытах по разделению суспензий карбоната кальция, карбоната магния и кизельгура на фильтрпрессе с диафрагмами. Найдено, что в пределах 2 - Ю5 - 8 - Ю6 Па объем влаги, удаленной из осадка при сжатии, пропорционален разности между давлениями при обезвоживании и фильтровании. Однако такое сжатие непосредственно связано с уменьшением проницаемости осадка по отношению к промывной жидкости.
Параметры этих зависимостей установлены в опытах по разделению суспензий карбоната кальция, карбоната магния и кизельгура на фильтрпрессе с диафрагмами. Найдено, что в пределах 2 - Ю5 - 8 - 10s Па объем влаги, удаленной из осадка при сжатии, пропорционален разности между давлениями при обезвоживании и фильтровании. Однако такое сжатие непосредственно связано с уменьшением проницаемости осадка по отношению к промывной жидкости.
Основным процессом в данном методе является взаимодействие сернистого ангидрида с суспензией карбоната кальция. Отходящие газы с температурой 150РС тангенциально вводятся в нижнюю часть абсорбционной колонны для охлаждения до температуры 50 - 60 С и насыщения водяными парами. Карбонат кальция распыляют для эффективного массообмена между газом и жидкостью в зоне абсорбции. Часть отработанной суспензии отводят в промежуточный сборник, в котором она укрепляется до 30 - 40 % за счет добавки свежего карбоната кальция и вновь подается на орошение. Остальную суспензию выдерживают в донной части колонны (ниже точки ввода газа), и в результате реакции растворенного сернистого ангидрида с сульфитом кальция (при рН 4 5 - 5 0) образуется Ca (HSO3h, который под действием кислорода воздуха превращается в сульфат кальция. Отработанная 4 % - ная суспензия сульфата кальция из гидроциклона рециркулирует в нижнюю часть колонны.
Благодаря очень малым размерам крупинок осадка карбоната кальция образуется молочно-белая жидкость - суспензия карбоната кальция в воде.
Департамент образования и науки Кемеровской области
ГБОУ СПО «Ленинск-Кузнецкий политехнический техникум»
Методическая разработка урока
Предмет: химия
Тема урока: лабораторная работа «Приготовление суспензии карбоната кальция»
Преподаватель: Т. В. Лошакова
Ленинск-Кузнецкий 2015
Введение ……………………………………3
Описание конспекта урока…………………4
Литература ………………………………….5
Приложения ……………………………… .6
Введение
Лабораторная работа «Приготовление суспензии карбоната кальция» проводится для обобщения и закрепления учебного материала после изучения темы «Дисперсные системы и растворы» в разделе «Общая и неорганическая химия» в части «Строение вещества», приобретения навыков обращения с лабораторным оборудованием и приобретения практических умений разделения смесей: растворов и дисперсных систем, что для групп строительных профессий имеет практическое значение. В ходе работы обучающиеся учатся самооценке собственной деятельности по предложенным критериям при заполнении листов самооценки, что способствует приобретению навыка адекватной самооценки и критического отношения к собственным действиям для формирования навыков самодисциплины и дальнейшего самосовершенствования.
Группа: -----
Профессия: мастер отделочных строительных работ
Тип урока: лабораторная работа
Форма проведения: классно-урочная
Количество времени : 2 урока (учебная пара)
Цель: закрепить знания о свойствах дисперсных систем и их отличии от истинных растворов, познакомиться со способами разделения смесей на примере суспензии карбоната кальция и раствора поваренной соли, приобрести навыки обращения с лабораторным оборудованием.
Оборудование и реактивы: молотый карбонат кальция (СаСО 3), штатив с пробирками, поваренная соль (NaCl ), вода, пробиркодержатель, спиртовка, спички.
Методы: лабораторная работа, словесный (объяснение), словесно-наглядный (объяснение с демонстрацией).
Этапы работы:
1 урок:
Организационный момент (пояснение цели и структуры занятия, формы его проведения) – 1- 2 минуты
Актуализация знаний: игра «Конкурс знатоков» 10-15 минут
Объяснение задач, техника безопасности – 5-7 минут
Оформление лабораторной работы – 15-20 минут
2 урок:
Выполнение лабораторной работы – 25- 30 минут
Подведение итогов работы, заполнение сводной таблицы, заполнение оценочных листов – 5-7 минут
Приведение в порядок рабочих мест, сдача отчетов -5 минут
Подведение результатов работы, выставление оценок, домашнее задание.
Описание конспекта урока
1. Организационный момент (пояснение цели и структуры занятия, формы его проведения)
2. Актуализация знаний игра «Конкурс знатоков»: обучающихся делят на две команды, назначают судью, по очереди члены команд вытягивают вопросы (по 3- 4 вопроса), затем задают свои вопросы членам команды-соперника, выслушивают и комментируют ответы. За каждый правильный ответ судья начисляет командам один балл, заполняет лист – опросник (вносит фамилию обучающегося и кол. баллов).
Вопросы: 1. Часто ли мы в жизни встречаемся с чистыми веществами, пример? (Не встречаемся, любое, даже химически чистое вещество обязательно содержит определенный процент примесей)
2. Что такое смеси, на какие классы их можно разделить? (Гомогенные (растворы) и гетерогенные (дисперсные системы))
3. Что такое гомогенные системы, пример? (Однородные системы, растворы, например р-р поваренной соли, размеры частиц фазы менее 1 нм – сопоставимы с размером молекул и ионов)
4. Что такое гетерогенные системы (или дисперсные), пример? (Системы, в которых размер частиц фазы более одного нм)
5. Приведите классификацию гетерогенных систем.(Взвеси и коллоидные растворы, разница в размере частиц фазы)
6. Что такое дисперсная фаза, среда?
7. Какими способами можно разделить взвеси? (Фильтрование, отстаивание, центрифугирование…)
8. Чем дисперсные системы отличаются от истинных растворов?(Размером частиц)
9. Как можно разделить вещества в водном растворе поваренной соли? (Выпариванием)
3. Объяснение задач лабораторной работы, вспоминаем технику безопасности при проведении лабораторных работ (общие правила) и правила нагревания веществ в пробирке, правила обращения со спиртовкой (преподаватель при помощи и подсказках учеников демонстрирует обращение со спиртовкой, правильное закрепление пробирки в пробиркодержателе, нагревание вещества в пробирке), обучающиеся расписываются в тетради инструктажа по ТБ.
4. В лабораторной тетради, пользуясь инструктивными картами, оформляют лабораторную работу.
5. Под руководством преподавателя приступают к лабораторной работе, выполняют ее.
6. Оформляют результаты работы в сводной таблице в лабораторной тетради, заполняют индивидуальные листы самооценки работы на занятии согласно представленным в листах критериям.
7. Приводят в порядок рабочие места. Сдают оборудование и отчеты – лабораторные тетради с листами самооценки.
8. Преподаватель подводит итоги работы, обращает внимание на ошибки и недочеты, поощряет отличившихся, озвучивает отметки за участие в «Конкурсе знатоков», комментирует домашнее задание.
Литература:
Габриелян, О.С. Химия. 11 класс. Учеб. для общеобразоват. учреждений. [Текст] О.С.Габриелян, Г.Г.Лысова. – М.: Дрофа, 2006. -386 с.
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений. [Текст] Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. – М., 2007.- 325с.
Приложения
Приложение 1
Лабораторная работа «Приготовление суспензии карбоната кальция»
Цель: познакомиться со способами разделения смесей на примере суспензии карбоната кальция и раствора поваренной соли
Оборудование и реактивы: молотый карбонат кальция (СаСО 3), штатив с пробирками, поваренная соль (NaCl ), вода, пробиркодержатель, спиртовка, спички.
Ход работы:
А) Рассмотрите вещества в пробирках, какое из них имеет кристаллическое строение, опишите вещества в сводной таблице.
Б) Добавьте в обе пробирки немного воды, взболтайте содержимое, пронаблюдайте, что происходит, наблюдения запишите в сводную таблицу, в какой пробирке образовался раствор, а в какой дисперсная система, укажите в дисперсной системе фазу и среду.
В) Поставьте обе пробирки в штатив и наблюдайте, что произойдет к концу урока, наблюдения занесите в таблицу.
Г) Добавьте в чистую пробирку немного раствора, каким способом можно разделить эту смесь?
Д) Закрепите пробирку с небольшим количеством раствора в пробиркодержателе, зажгите спиртовку и произведите выпаривание раствора поваренной соли соблюдая технику безопасности, наблюдения занесите в таблицу.
5. Оформите работу в тетради (заполните сводную таблицу), заполните самооценочный лист.
Наблюдения:
Суспензия карбоната кальция: (СаСО 3)
Раствор хлорида натрия: (NaCl)
Приложение 2
Самооценочный лист
Фамилия:
Соблюдение дисциплины, правил поведения, тишины, отметки о нарушениях
Участие в ответах команды знатоков
Количество правильных ответов на вопросы
Соблюдение техники безопасности при выполнении работы
Правильный порядок действий (согласно хода работы) и аккуратность при выполнении работы
Оценка
Приложение 3
Лист-опросник
Вопрос:
Команда 1
Команда 2
Фамилия ответившего:
Баллы: